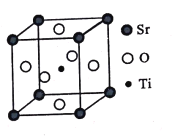
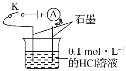
题目内容
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
【答案】D
【解析】
一块表面已被氧化为氧化钠的钠块投入水中发生的反应为2Na+2H2O=2NaOH+H2↑、Na2O+H2O=2NaOH,根据生成氢气和Na之间的关系式计算和水反应的Na的质量,根据氧化钠和被空气氧化的钠的关系式计算原来被氧化的钠的质量。
标准状态下的1.12 L H2的物质的量为![]() =0.05mol,质量为0.1g,设和水反应的Na的质量为x,
=0.05mol,质量为0.1g,设和水反应的Na的质量为x,
2Na+2H2O=2NaOH+H2↑
46g 2g
x 0.1g
![]() =
=![]() ,解得:x=2.3g,则氧化钠的质量=5.4g-2.3g=3.1g,氧化钠中含有的钠的质量为
,解得:x=2.3g,则氧化钠的质量=5.4g-2.3g=3.1g,氧化钠中含有的钠的质量为![]() ×3.1g=2.3g,故选D。
×3.1g=2.3g,故选D。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A | 向 | 黄色逐渐消失,加 | 还原性: |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 |
|
C | 向某溶液中先加入氯水,再加入 | 加入 | 最初溶液中含有 |
D | 向2支盛有 | 两只试管中固体均溶解 | 氧化铝是两性氧化物 |
A. AB. BC. CD. D
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
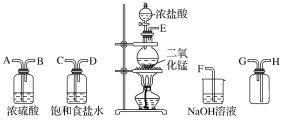
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。