题目内容
【题目】实验室需要0.1 molL1NaOH溶液500mL和0.5 molL1硫酸溶液480mL。根据这两种溶液的配制情况回答下列问题:
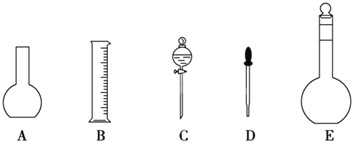
(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器有玻璃棒和______(填仪器名称)。
(2)容量瓶使用前必须进行的一步操作是___________。
(3)根据计算,该实验用托盘天平称取NaOH的质量为______g。在实验中其他操作均正确,若称量NaOH溶液时砝码生锈,则所得溶液浓度______0.1molL1(填“大于”“等于”或“小于”,下同)。若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度______0.1molL1。
(4)在配制稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:___________。
②定容时仰视观察液面:___________。
③用量筒量取浓硫酸时俯视:______________。
(5)在实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度,应_________;加蒸馏水到刻度下1cm ~ 2 cm处应__________滴加至凹液面最低处与刻度线相切;移液时不慎将少量液滴滴在容量瓶外面,应_____________。
【答案】AC 烧杯 检查容量瓶是否漏水 2.0g 大于 小于 偏高 偏低 偏高 倒掉,重新配制 用胶头滴管 倒掉,重新配制
【解析】
(1)配制溶液时,将固体在烧杯中溶解(液体在烧杯中稀释),冷却后沿玻璃棒将溶液引流入容量瓶中,用蒸馏水洗涤烧杯和玻璃棒2-3次,将洗涤液也注入容量瓶中,向容量瓶中加水,至距刻度线1-2cm处改用胶头滴管滴加水,直至凹液面最低点与刻度线相切,倒转,摇匀,溶液配制完成。
(2)配制溶液前要检查容量瓶是否漏水;
(3)根据m=cVM计算固体的质量;称量时砝码生锈,称得的溶质质量增大;洒落溶液后,使溶质的量减少;
(4)①液体有热胀冷缩的特点;②定容时仰视观察液面,导致量取的液体体积偏大;
③用量筒量取浓硫酸时俯视导致量取的液体体积偏小;
(5)在配制溶液的过程中,只要进行了错误的操作,溶液都应该倒掉,重新配制。
(1)由分析可知,配制溶液时需要用到烧杯、玻璃棒、容量瓶,胶头滴管,如图所示的仪器中一定不需要的是烧瓶和分液漏斗;配制溶液时还需要用到的是烧杯和玻璃棒;
(2)配制溶液前要检查容量瓶是否漏水;
(3)m=cVM=0.1molL-1×0.5L×40g/mol=2.0g;称量时砝码生锈,称得的溶质质量增大,物质的量增大,浓度偏大,因此大于0.1molL1;转移液体时洒落了少许,溶质减少,导致浓度偏低,因此则所得溶液浓度小于0.1molL1;
(4)①液体有热胀冷缩的特点,液体冷却后,体积缩小,导致浓度偏高;
②定容时仰视观察液面,导致量取的液体体积偏大,浓度偏低;
③用量筒量取浓硫酸时俯视导致量取的液体体积偏小,浓度偏高;
(5)在配制溶液的过程中,只要进行了错误的操作,溶液都应该倒掉,重新配制,因而加蒸馏水时不慎超过了刻度,应将液体倒掉,重新配制;加蒸馏水到刻度下1cm ~ 2 cm处应改用胶头滴管滴加至凹液面最低处与刻度线相切;移液时不慎将少量液滴滴在容量瓶外面,应将液体倒掉,重新配制。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】硝基苯甲酸乙酯在OH-存在下发生水解反应:O2NC6H4COOC2H5+OH-O2NC6H4COOO-+C2H5OH两种反应物的初始浓度均为0.050mol/L,在不同温度下测得O2NC6H4COOC2H5的浓度(mol/L)随时间变化的数据如下表所示。下列有关说法不正确的是( )
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
15℃ | 0.500 | 0.335 | 0.291 | 0.256 | 0.210 | 0.155 | 0.148 | 0.145 | 0.145 |
35℃ | 0.500 | 0.325 | 0.2775 | 0.238 | 0.190 | … | 0.135 | 0.135 | 0.135 |
A. 该反应在![]() ,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
,120180s区间内O2NC6H4COOC2H5平均反应速率为7.33×10 -4 mol·L-1·s-1
B. 由数据可知,随着反应的进行,反应物的浓度降低,反应速率减慢
C. 530s时,表格中35℃对应的数据一定是0.135
D. 由数据可知,温度升高反应速率加快