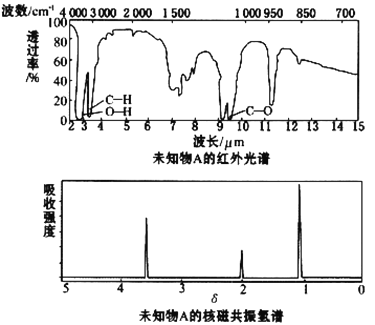
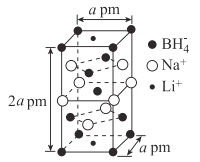
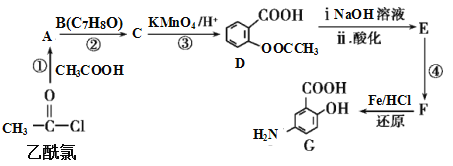
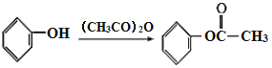
题目内容
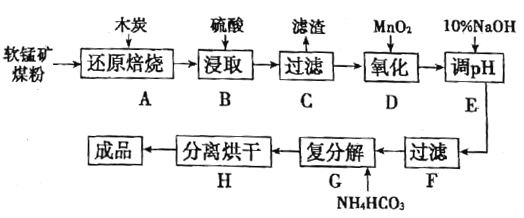
【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
【答案】坩埚 C、Cu和CaSO4 )1∶2 3.7≤pH<8.1 使Fe3+转化为Fe(OH)3而除去,而不影响Mn2+ 减少碳酸氢铵的分解,提高原料利用率 2.2×10-11 取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净 6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O 25%
+14H+=6Fe3++2Cr3++7H2O 25%
【解析】
软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)加木炭焙烧,主要发生2MnO2+C![]() 2MnO+CO2↑,且C与Fe2O3、CuO发生反应,生成Fe、Cu,再用硫酸酸浸过滤得到MnSO4、FeSO4溶液,过滤分离出滤渣为不与硫酸反应的Cu、过量的木炭以及CaCO3转化成的CaSO4,再加入MnO2氧化,加NaOH调节pH除去Fe3+得到MnSO4,最后与NH4HCO3反应生成MnCO3,分离烘干得到MnCO3,据此分析解答。
2MnO+CO2↑,且C与Fe2O3、CuO发生反应,生成Fe、Cu,再用硫酸酸浸过滤得到MnSO4、FeSO4溶液,过滤分离出滤渣为不与硫酸反应的Cu、过量的木炭以及CaCO3转化成的CaSO4,再加入MnO2氧化,加NaOH调节pH除去Fe3+得到MnSO4,最后与NH4HCO3反应生成MnCO3,分离烘干得到MnCO3,据此分析解答。
(1)高温焙烧物质应在坩埚中进行;根据分析可知滤渣为C、Cu和CaSO4;
(2)步骤D中MnO2被还原成Mn2+,化合价降低2价,Fe2+被氧化成Fe3+,化合价升高1价,根据得失电子守恒,氧化剂与还原剂的物质的量之比为1: 2;
(3)此时溶液中的杂质主要为Fe3+,结合表中数据可知步骤E中调节pH的范围为3.7≤pH<8.3,其目的是使铁离子转化为Fe(OH)3而除去,而不影响Mn2+;
(4)铵盐不稳定,受热易分解,所以步骤G中温度需控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;Mn2+恰好沉淀完全时可认为c(Mn2+)=10-5mol/L,Ksp(MnCO3)=c(Mn2+)c(CO32-)=10-5×2.2×10-6=2.2×10-11;
(5)生成的MnCO3沉淀可能附着有硫酸盐,所以检验是否含有硫酸根即可确认沉淀是否洗涤干净,具体操作为:取少量最后一次的洗涤液于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净;
(6)①酸性K2Cr2O7具有强氧化性,可以把亚铁离子氧化成铁离子,自身被还原成Cr3+,根据电子守恒、电荷守恒和原子守恒,离子方程式为:6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O;
+14H+=6Fe3++2Cr3++7H2O;
②根据方程式6Fe2++![]() +14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500molL-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500molL-1×0.06L-0.015=0.015mol,根据化学反应方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可知,n(Mn)=0.015mol,所以锰元素的质量分数为
+14H+=6Fe3++2Cr3++7H2O可知剩余n(Fe2+)= 0.500molL-1×0.005L×6=0.015mol,则与[Mn(PO4)2]3-反应的n(Fe2+)=0.500molL-1×0.06L-0.015=0.015mol,根据化学反应方程式[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可知,n(Mn)=0.015mol,所以锰元素的质量分数为![]() ×100%=25%。
×100%=25%。