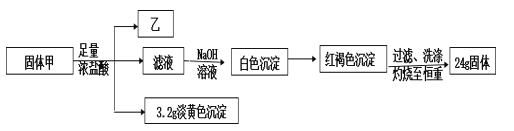
题目内容
【题目】硼及其化合物在工农业生产中具有广泛应用。
请回答下列问题:
(1)基态B原子的价电子排布图___,B属于元素周期表中的___区元素。
(2)NaBO2可用于织物漂白。
①第二周期中第一电离能介于B和O之间的元素为___(填元素符号)。
②BO2-的空间构型为____,写出两种与其互为等电子体的分子的化学式:____。
(3)BF3和F-可以形成BF4-,BF3和BF4-中B原子的杂化方式分别为_____、____。
(4)立方BN和立方AlN均为原子晶体,结构相似,BN的熔点高于AlN的原因为______。
(5)一种新型轻质储氢材料的晶胞结构如图所示:
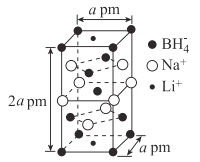
①该化合物的化学式为____。
②设阿伏加德罗常数的值为NA,该晶体的密度为___g·cm-3(用含a、NA的代数式表示)。
【答案】![]() p Be、C 直线形 CO2或CS2或N2O或BeCl2 sp2 sp3 B原子半径更小,B—N键键长更短,键能更大 Na3Li(BH4)4
p Be、C 直线形 CO2或CS2或N2O或BeCl2 sp2 sp3 B原子半径更小,B—N键键长更短,键能更大 Na3Li(BH4)4 ![]()
【解析】
(1)硼为5号元素,属于p区元素,其基态原子的价电子排布图为![]() 。故答案为:
。故答案为:![]() ,p。
,p。
(2)①Be的2s能级处于全满,第一电离能:Be>B,N的2p能级处于半满,第一电离能:N>O,故第一电离能介于B和O之间的元素只有Be、C两种。
②![]() 的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与
的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与![]() 互为等电子体的分子有CO2、CS2、N2O、BeCl2等。故答案为:直线形,CO2或CS2或N2O或BeCl2。
互为等电子体的分子有CO2、CS2、N2O、BeCl2等。故答案为:直线形,CO2或CS2或N2O或BeCl2。
(3)BF3和![]() 中B原子的价层电子对数分别为2、3,所以其杂化方式分别为sp2、sp3。
中B原子的价层电子对数分别为2、3,所以其杂化方式分别为sp2、sp3。
(4)立方BN和立方AlN均为原子晶体,B原子半径更小,B—N键键长更短,键能更大,熔点更高。
(5)①根据均摊法可得,该物质的化学式为Na3Li(BH4)4。
②![]() ,该晶体的密度
,该晶体的密度![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】通过下表的相关数据,计算、分析、判断给出结论,题目所给数据和条件均为常温下,
NH3H2O | Kb=1.8×10-5 |
H2CO3 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
HF | Ka=6.8×10-4 |
H2S | Ka1=1.3×10-7 Ka2=7.1×10-15 |
H2O | Kw=10-14 |
Cu(OH)2 | Ksp=2.2×10-20 |
Fe(OH)3 | Ksp=4.0×10-38 |
CuS | Ksp=6.3×10-36 |
FeS | Ksp=3.6×10-18 |
常用对数 | lg2=0.3 lg2.2=0.34 lg3=0.48 |
(1)NH4F 溶液显____性,保存此溶液应该放在__________中。
(2)NH4HCO3 溶液与少量 NaOH 溶液反应时,_____ (填离子符号)先与 NaOH 溶液中的 OH-反应。
(3)向含Fe3+和Cu2+均为0.1mol/L的溶液中加入某碱调节pH=___时,Fe3+完全沉淀,当pH=_____时,Cu2+开始沉淀,
(4)反应 CuS(s) + H2SO4(aq)![]() H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq)
H2S(aq) + CuSO4(aq)的 K= _____________;反应 FeS(s) + H2SO4(aq) ![]() H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)
H2S(aq) + FeSO4 (aq)的 K=___________;反应 CuS(s)+Fe2+(aq)![]() FeS(s)+Cu2+(aq)的 K=_______
FeS(s)+Cu2+(aq)的 K=_______
由计算结果可以知道:实验室制备H2S气体应选用_________,检验H2S气体应选用_________(均用上述反应中的盐类物质作答)
除去废水中的 Cu2+使用 过量的 FeS 固体的优点有:
a.可以除去废水中的 Cu2+,过量的 FeS 和生成的 CuS 可以通过过滤一并除去
b.____________________________________________________________________