题目内容
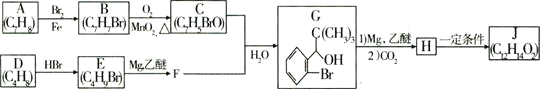
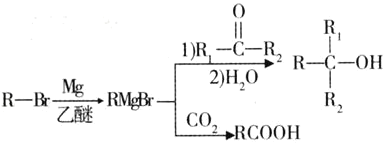
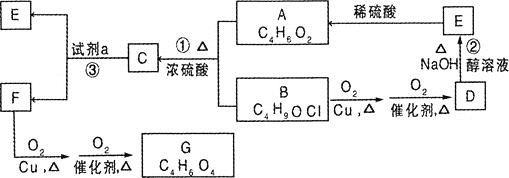
【题目】有机物A是制备血管紧张素抑制剂卡托普利的原料,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为![]() ,已知B的结构中只有一个甲基,下图是以B为主要原料的合成路线。试回答下列问题:
,已知B的结构中只有一个甲基,下图是以B为主要原料的合成路线。试回答下列问题:
(1)![]() 的名称是________,D含有的官能团名称是________。
的名称是________,D含有的官能团名称是________。
(2)写出反应![]() 的化学方程式:________,该反应的反应类型是________,反应
的化学方程式:________,该反应的反应类型是________,反应![]() 的反应类型是________。
的反应类型是________。
(3)反应![]() 中的试剂a是:________;
中的试剂a是:________;
(4)写出G的结构简式:________;
(5)![]() 的同分异构体有多种,能发生水解反应的有________种,写出其中既能发生水解反应,又能发生银镜反应的有机物的结构简式:________。
的同分异构体有多种,能发生水解反应的有________种,写出其中既能发生水解反应,又能发生银镜反应的有机物的结构简式:________。![]() 写出一种即可
写出一种即可![]()
【答案】![]() 甲基丙烯酸 羧基、氯原子
甲基丙烯酸 羧基、氯原子 ![]() +H2O 酯化反应
+H2O 酯化反应![]() 取代反应
取代反应![]() 消去反应
消去反应 ![]() 溶液
溶液 ![]() 5
5 ![]() 或
或 ![]() 或
或![]()
【解析】
有机物A分子式![]() ,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为
,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为![]() ,可知A的结构简式为
,可知A的结构简式为![]() ,因为B的结构中只有一个甲基,且根据框图中B的分子式为
,因为B的结构中只有一个甲基,且根据框图中B的分子式为![]() ,B又可连续氧化,说明B既含有羟基又含有氯原子,B中羟基连续氧化生成羧基,所以B结构简式为
,B又可连续氧化,说明B既含有羟基又含有氯原子,B中羟基连续氧化生成羧基,所以B结构简式为![]() ,D的结构简式为
,D的结构简式为![]() ,D在碱性条件下与醇溶液发生消去反应生成E;
,D在碱性条件下与醇溶液发生消去反应生成E;
(1)有机物A分子式![]() ,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为
,其核磁共振氢谱图中有3个吸收峰,吸收峰的面积比为![]() ,可知A的结构简式为
,可知A的结构简式为![]() ,因为B的结构中只有一个甲基,且根据框图中B的分子式为
,因为B的结构中只有一个甲基,且根据框图中B的分子式为![]() ,B又可连续氧化,说明B既含有羟基又含有氯原子,B中羟基连续氧化生成羧基,所以D中既含有羧基又含有氯原子,故答案为:
,B又可连续氧化,说明B既含有羟基又含有氯原子,B中羟基连续氧化生成羧基,所以D中既含有羧基又含有氯原子,故答案为:![]() 甲基丙烯酸;羧基、氯原子;
甲基丙烯酸;羧基、氯原子;
(2)A是![]() ,因为B的结构中只有一个甲基,且根据框图中B的分子式和B可连续氧化,说明B既含有羟基又含有氯原子,
,因为B的结构中只有一个甲基,且根据框图中B的分子式和B可连续氧化,说明B既含有羟基又含有氯原子,![]() ,碳骨架不变,所以B结构简式为
,碳骨架不变,所以B结构简式为![]() ,在浓硫酸并加热条件下与A发生酯化反应生成酯C,由D中既含有羧基又含有氯原子和反应
,在浓硫酸并加热条件下与A发生酯化反应生成酯C,由D中既含有羧基又含有氯原子和反应![]() 条件可知是卤代烃的消去反应,故答案为:
条件可知是卤代烃的消去反应,故答案为:![]() +H2O;酯化反应
+H2O;酯化反应![]() 取代反应
取代反应![]() ;消去反应;
;消去反应;
(3)由框图可知C在a试剂存在条件下生成E和F,且E是![]() ,F可连续氧化,说明F含有羟基,所以F结构简式为
,F可连续氧化,说明F含有羟基,所以F结构简式为![]() ,所以是发生了碱性条件下的水解,故答案为:NaOH溶液;
,所以是发生了碱性条件下的水解,故答案为:NaOH溶液;
(4)F为![]() 连续氧化生成
连续氧化生成![]() ,故答案为:
,故答案为:![]() ;
;
(5)A![]() 的同分异构体中能发生水解反应的属于酯类,HCOOH和C=C—C(羟基有三种位置)形成的酯有三种,CH3COOH和乙烯醇形成的酯有1种,CH2=CHCOOH和CH3OH形成的酯有1种,共有5种,其中既能发生水解反应,又能发生银镜反应的有机物,结构中既含有酯基又含有醛基,应为甲酸酯,故答案为:5;
的同分异构体中能发生水解反应的属于酯类,HCOOH和C=C—C(羟基有三种位置)形成的酯有三种,CH3COOH和乙烯醇形成的酯有1种,CH2=CHCOOH和CH3OH形成的酯有1种,共有5种,其中既能发生水解反应,又能发生银镜反应的有机物,结构中既含有酯基又含有醛基,应为甲酸酯,故答案为:5;![]() 或
或 ![]() 或
或![]() 。
。

【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
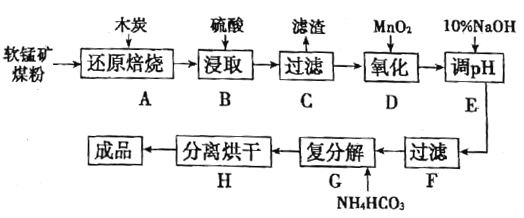
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。