题目内容
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
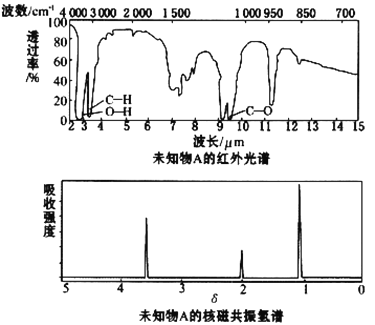
A.由红外光谱可知,该有机物中至少含有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由其核磁共振氢谱可知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3CH2OH
【答案】C
【解析】
A.红外光谱图中有C-H、O-H、C-O,因此至少有碳氢键,氧氢键,碳氧单键三种化学键,A正确;
B.该有机物分子有三个吸收峰,该有机物分子中有三种不同的氢原子,B正确;
C.若不知A的分子式,则无法确定氢原子总数,C错误;
D.若A的化学式为C2H6O,其结构简式有两种:CH3CH2OH或CH3OCH3,氢原子个数比为l:2:3,只能是CH3CH2OH,D正确;
答案选C。

【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
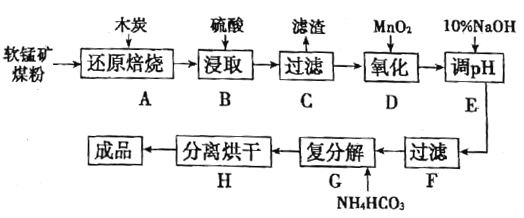
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。