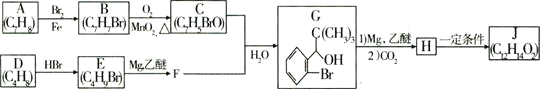
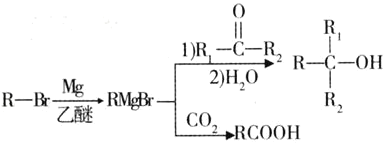
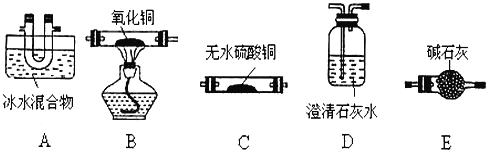
题目内容
【题目】![]() (环戊二烯)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是( )
(环戊二烯)容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法不正确的是( )
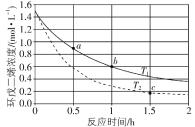
A.T1小于T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L1
【答案】B
【解析】
A.单位时间T2温度下,环戊二烯浓度变化大,因此速率快,则反应温度高,因此T1小于T2,故A正确;
B.a点浓度大,温度低,c点浓度小,温度高,因此a的反应速率与c点的反应速率不能比较,故B错误;
C.a点环戊二烯浓度大于b点环戊二烯浓度,因此a点的正反应速率大于b点的正反应速率,而b点的正反应速率大于b点的逆反应速率,因此a点的正反应速率大于b点的逆反应速率,故C正确;
D.b点时环戊二烯浓度浓度改变理论0.9 mol·L1,因此二聚体的浓度为0.45 mol·L1,故D正确;
综上所述,答案为B。

【题目】高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
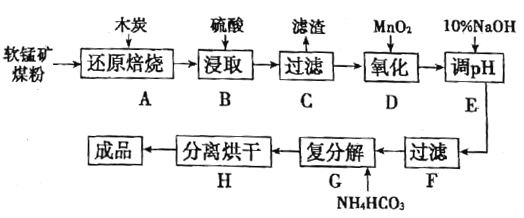
已知:还原焙烧主反应为2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________中加热;步骤C中的滤渣为__________。
(2)步骤D中氧化剂与还原剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为__________,其目的是__________。
(4)步骤G,温度控制在35℃以下的原因是__________,若Mn2+恰好沉淀完全时测得溶液中![]() 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=__________。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是__________。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中![]() 完全转化为
完全转化为![]() );加入稍过量的硫酸铵,发生反应
);加入稍过量的硫酸铵,发生反应![]() +
+![]() =N2↑+2H2O以除去
=N2↑+2H2O以除去![]() ;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO
;加入稀硫酸酸化,再加入60.00mL0.500mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO![]() ;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00mL0.500mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程为__________。
②试样中锰元素的质量分数为__________。
【题目】(1)请用下列10种物质的序号填空:①O2②H2③NH4NO3④K2O2⑤Ba(OH)2⑥CH4⑦CO2⑧NaF ⑨NH3⑩I2
既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为:______________;若XY2为共价化合物时,其结构式为:__________________。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃(2.02×103Pa),但在180℃就开始升华,据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据是____________________。
(4)现有a~g 7种短周期元素,它们在周期表中的位置如下,请据此回答下列问题:

①元素的原子间反应最容易形成离子键的是________(填序号,下同),容易形成共价键的是______;
A.c和f | B.b和g | C.d和g | D.b和e |
②写出a~g 7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式______。
【题目】硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是_______。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有_______。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
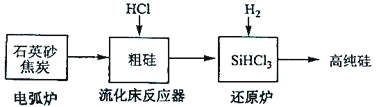
发生的主要反应 | |
电弧炉 | SiO2+2C |
流化床反应器 | Si+3HCl |
还原炉 | SiHCl3+H2 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为_______;碳化硅又称_______,其晶体结构与_______相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_______。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为_______。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是_______。
【题目】实验室用卤块(主要成分为MgCl2·6H2O,含有MgSO4.FeCl2等杂质)制备少量Mg(ClO3)2·6H2O的流程如下:
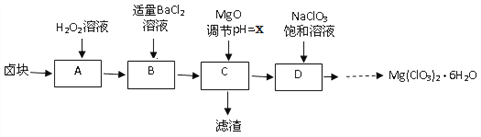

已知:①四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
②室温时一些物质的Ksp如下表:
化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
③Mg(ClO3)2有较强的氧化性,其还原产物是Cl-.
(1)H2O2的电子式为_________
(2)滤渣的成分是____________(填化学式);
(3)经测定,D中铁离子的浓度为1×10-5 mol/L,则x为______
(4)D中所发生的化学反应方程式为_____,框图中由D→......→制Mg(ClO3)2·6H2O晶体的实验步骤依次为:①加热蒸发;②_______(请补充);③冷却结晶;④过滤洗涤。
(5)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL试液于锥形瓶中,加入10.00 mL稀硫酸和20 .00mL 1.000 mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。
步骤4:将步骤2、3重复两次
①步骤3中发生反应的离子方程式____________
②步骤3中若滴定前不用标准液润洗滴定管,将会导致最终结果_____(填“偏大”. “偏小”或“不变”)。
③若平均消耗K2Cr2O7溶液15.00 mL,则产品中Mg(ClO3)2·6H2O(其M=299g/mol)的质量分数为___________