题目内容
7.在一定温度下,可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡的标志是( )| A. | NH3的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、NH3的生成速率与NH3的分解速率相等,正逆反应速率相等,故A正确;
B、都反映是正反应,未体现正与逆的关系,故B错误;
C、N2、H2、NH3的浓度不再发生变化,说明正逆反应速率相等,故C正确;
D、当体系达平衡状态时,N2、H2、NH3的物质的量之比可能为1:3:2,也可能不是1:3:2,与各物质的初始浓度及转化率有关,故D错误;
故选AC.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
17.下列化合物中,属于原子晶体的是( )
| A. | CO2 | B. | NaOH | C. | SiO2 | D. | Si |
18.下列各组物质中,互为同分异构体的是( )
| A. | O2和O3 | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 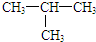 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
15.一位患者镶了两颗假牙,其中一颗是黄金的,另一颗是不锈钢的.自镶上假牙后,他时感头疼,心情烦躁,多次治疗未见好转.如果你是医生,下列方法不能治疗其疾病的是( )
| A. | 将两颗假牙都做成黄金的 | B. | 将两颗假牙都做成不锈钢的 | ||
| C. | 将金假牙改为铝质假牙 | D. | 将两颗假牙都做成特殊树脂的 |
2.汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)?N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是( )
| A. | 只要使用合理的催化剂及载体,就可完全清除NO和CO | |
| B. | 使用催化剂只能改变反应的速率不能改变反应的平衡常数 | |
| C. | 假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) | |
| D. | 恒容条件下,通入惰性气体可提高NO转化率 |
12.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol•L-1 FeCl2溶液,实验记录如表(a、b、c代表电压值):
(1)用KSCN溶液检验出溶液中含Fe3+,看到的现象是溶液变红.
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
①NaCl溶液的浓度应是0.2 mol•L-1.
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化.写出Cl2氧化Fe2+的离子方程式:Cl2+2Fe2+═2Cl-+2Fe3+.
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电.原因是Fe2+具有还原性.
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证.控制变量,做对照实验继续探究:电解pH=1的NaCl溶液,记录如表:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②Ⅳ中检验Cl2的实验方法:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色.
③与Ⅱ对比,得出的结论:通过控制电压,证实了产生Fe3+的两种原因都成立;通过控制电压,验证了放电顺序是:Fe2+>Cl-(填“>”或“<”)
19.已知一定温度时:N2(g)+3H2 (g)?2NH3(g).当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q.则下列关系式中正确的是( )
| A. | Q=92 kJ | B. | Q<92 kJ | C. | Q>92 kJ | D. | Q=194kJ |
16.碘硫化学循环原理如图1所示.
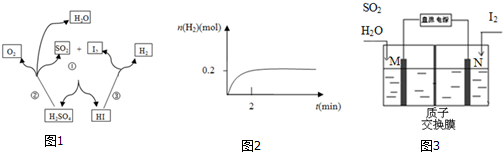
(1)写出反应③的化学方程式2HI△?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=164.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为43:7.
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.

(1)写出反应③的化学方程式2HI△?H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=164.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
17.以NA表示阿伏加德罗常数,则下列说法正确的是( )
| A. | 1 mol NH3分子中含有3NA个σ键和4NA个sp3杂化轨道 | |
| B. | 1 mol CO2分子中含有2NA个σ键和2NA个sp2杂化轨道 | |
| C. | 1 mol C2H2分子中含有2NA个σ键、2NA个π键 | |
| D. | 1 mol C2H4分子中含有4NA个σ键、2NA个π键 |