题目内容
16.碘硫化学循环原理如图1所示.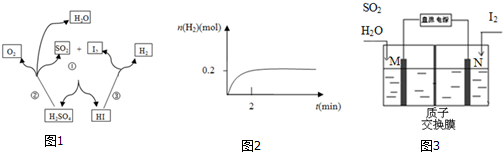
(1)写出反应③的化学方程式2HI$\stackrel{△}{?}$H2+I2,一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K=$\frac{1}{64}$.
(2)写出反应①的化学方程式I2+SO2+2H2O=2HI+H2SO4,其中SO2体现的是还原性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是H2.
(4)氧缺位铁酸铜(CuFe2O4-δ)是反应②的良好的催化剂.实验室用如下方法制得:
Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4,得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O
②研究发现:
| 温度 | 元素存在形式 |
| 1200-1350K | Fe3+部分转变为Fe2+ |
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式SO2+2H2O-2e-=4H++SO42-.请用文字说明在N极能够获得所需物质的原因是M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
分析 (1)由图可知碘化氢分解生成单质碘和氢气;依据平衡常数概念计算K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$计算;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸;反应中S元素的化合价升高;
(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气;
(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3;
②根据化合价的代数和为零计算;
(5)电解时二氧化硫在阳极失电子生成硫酸;碘单质在N极得电子生成碘离子,与氢离子结合形成HI.
解答 解:(1)由图可知碘化氢分解生成单质碘和氢气,其反应的方程式为:2HI$\stackrel{△}{?}$H2+I2;
2HI $\stackrel{△}{?}$ H2 +I2
起始的浓度(mol/L):1 0 0
转化的浓度(mol/L):0.2 0.1 0.1
平衡的浓度(mol/L):0.8 0.1 0.1
则K=$\frac{c({H}_{2})×c({I}_{2})}{{c}^{2}(HI)}$=$\frac{0.1×0.1}{0.{8}^{2}}$=$\frac{1}{64}$;
故答案为:2HI$\stackrel{△}{?}$H2+I2;$\frac{1}{64}$;
(2)反应①为二氧化硫与单质碘反应生成HI和硫酸,其反应的方程式为:I2+SO2+2H2O=2HI+H2SO4;反应中S元素的化合价升高,则二氧化硫被氧化作还原剂,体现还原性;
故答案为:I2+SO2+2H2O=2HI+H2SO4;还原;
(3)二氧化硫和水、碘单质发生本生反应生成硫酸、氢碘酸,碘化氢分解生成碘和氢气,所以该反应释放的能源气体为氢气;
故答案为:H2;
(4)①Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液反应生成CuFe2O4和KNO3,其反应的方程式为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;
故答案为:2Fe(NO3)3+Cu(NO3)2+8KOH=CuFe2O4+8KNO3+4H2O;
②设CuFe2O3.86中Fe3+个数为x,Fe2+的个数为y,
由化合价的代数和为零得:2+3x+2y+(-2)×3.86=0,x+y=2,
则解得:$\frac{x}{y}$=43:7,所以CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 43:7;
故答案为:43:7;
(5)电解时二氧化硫在阳极失电子生成硫酸,其电极方程式为:SO2+2H2O-2e-=4H++SO42-;碘单质在N极得电子生成碘离子,M极附近产生的H+通过质子交换膜移动到N极附近,碘离子与氢离子结合形成HI;
故答案为:SO2+2H2O-2e-=4H++SO42-;M极附近产生的H+通过质子交换膜移动到N极附近,与I2失电子后得到的I-形成HI溶液.
点评 本题考查了化学平衡常数的计算、氧化还原反应、化学方程式的书写、电解原理的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握电解原理及电极方程式的书写方法.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | NH3的生成速率与NH3的分解速率相等 | |
| B. | 单位时间内生成nmolN2的同时生成3nmolH2 | |
| C. | N2、H2、NH3的浓度不再发生变化 | |
| D. | N2、H2、NH3的物质的量之比为1:3:2 |
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO溶液制备HClO |
| A. | A | B. | B | C. | C | D. | D |
(1)早期冶炼金属锰的一种方法是先缎烧软锰矿生成Mn304,再利用铝热反应原理由Mn3O4制备锰.该铝热反应的化学方程式为8Al+3Mn3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Mn
(2)现代冶炼金属锰的一种工艺流程如图所示:

下表t℃时,有关物质的pKap(注pKap=-1Kap).
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKap | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
该反应中,还原剂为C6H12O6.写出一种能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等
②滤液1的pH>(填“>”“<”或“=”)MnS04浸出液的pH.
③加入MnF2的目的是除去Ca2+(填“Ca2+”“Fe3+”或“Cu2+”).
(3)由MnS04制取MnC03.往MnS04溶液中加人NH4HC03溶液,析出MnC03沉淀并逸出C02气体,该反应的离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;若往MnS04溶液中加人(NH4)2C03溶液,还会产生Mn(OH) 2,可能的原因有:MnCO3(s)+2OH-(aq)?Mn(OH)2(s)+CO32-(aq),t℃时,该反应的平衡常数K=100(填数值).
| A. | 2-乙基戊烷 | B. | 1,2-二甲基丁烷 | ||
| C. | 3,3-二甲基-1-丁稀 | D. | 3,4-二甲基戊烷 |
| 操作和现象 | 结论 | |
| A | 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 向某溶液中加入新制Cu(OH)2,加热出现红色沉淀 | 证明溶液中一定含醛类物质 |
| C | 取2mL 溴乙烷,加入适量NaOH水溶液,加热.一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 | 溴乙烷中的Br变成了Br- |
| D | 取2mL 溴乙烷,加入适量NaOH乙醇溶液,加热.将产生的气体通入Br2的四氯化碳溶液中,溶液褪色 | 反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |