题目内容
9.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:(1)Ti元素在元素周期表中的位置是第四周期第IVB族;其基态原子的电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2.
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定
性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图
1所示,它的化学式是BaTiO3,其中Ti4+的氧配位数为6,Ba2+的氧配位数为12,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是共价化合物,其固体是分子晶体.TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有HCl生成.
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用如图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子).配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有2种同分异构体,请在如图4的方框中将其画出.

分析 (1)根据元素周期表可知Ti元素的位置,根据核外电子排布规律可写出Ti元素的基态原子的价电子层排布式;
(2)在每个晶胞中均有一个Ba原子,四个Ti原子被四个晶胞共用,每个晶胞中只有一个Ti,12个C原子均被四个晶胞共用,每个晶胞中含有3个O原子;
(3)根据题目中提供的物理性质来判断晶体类型;HCl遇水形成盐酸小液滴,呈雾状;
(4)Co3+位于正八面体的中心,NH3和Cl-位于正八面体顶点,当两个Cl-相邻时为一种结构,两个Cl-不相邻时为另一种结构,共有两种结构.
解答 解:(1)根据元素周期表可知Ti元素位于元素周期表的第四周期第ⅣB族,Ti元素是24号元素,根据核外电子排布规律可知,它的基态原子的电子层排布式为:1s22s22p63s23p63d24s2或[Ar]3d24s2,故答案为:四;IVB;1s22s22p63s23p63d24s2或[Ar]3d24s2;
(2)在每个晶胞中均有一个Ba原子,四个Ti原子被四个晶胞共用,每个晶胞中只有一个Ti,12个O原子均被四个晶胞共用,每个晶胞中含有3个O原子,故化学式为BaTiO3,Ti4+的氧配位数为$3×8×\frac{1}{4}$=6,Ba2+的氧配位数为12,故答案为:BaTiO3;6;12;
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,熔沸点较低,晶体由分子形成,属于分子晶体,分子由共价键形成,TiCl4在潮湿空气中易挥发,水解而冒白烟,有HCl生成,故答案为:共价;分子;HC1;
(4)Co3+位于正八面体的中心,NH3和Cl-位于正八面体顶点,当两个Cl-相邻时为一种结构,两个Cl-不相邻时为另一种结构,共有两种结构,即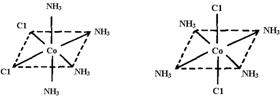 故答案为:2;
故答案为:2; .
.
点评 本题考查了原子核外电子排布、晶胞的计算、配合物、分子间作用力对物质的状态等方面的影响以及同分异构体等内容,综合性强,难度较大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NaCl | B. | C | C. | Fe | D. | Ar |

| A. | 混合物中一定不存在FeCl2和NaCl | |
| B. | 反应④的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ | |
| C. | 混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 | |
| D. | 白色沉淀5.80g是Mg(OH)2 |
下列说法中错误的是 ( )
| A. | PFS中铁显+3价 | |||||||||||||||
| B. | 铁原子的价电子排布式是3d74s1 | |||||||||||||||
| C. | 由FeSO4溶液制PFS需经过氧化、水解和聚合的过程 | |||||||||||||||
| D. | 由下表可知气态Fe2+再失去一个电子比气态Mn2+再失去一个电子难
| |||||||||||||||
| A. | 用过滤法除去Fe(OH)3胶体中的FeCl3 | |
| B. | 用25mL碱式滴定管量取20.10mLNa2CO3溶液 | |
| C. | 将SO2通入酸性KMnO4溶液中,可证明SO2具有漂白性 | |
| D. | 欲鉴别AlC13溶液和AgNO3溶液,向2种待测液中分别滴加足量氨水 |
| A. | SO42- | B. | NH4+ | C. | H+ | D. | OH- |
| A. | “超纯水”、“超纯蒸馏水”绝对卫生,对人体有益 | |
| B. | 含碘食盐可防治甲状腺肿大,但也不能滥补,造成体内碘含量过高 | |
| C. | 本饮料由纯天然物质配置而成,绝对不含化学物质,对人体无害 | |
| D. | 含氟牙膏可适合任何人群预防龋齿 |
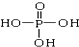 、
、 交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答:
交换后的溶液用0.1mol•L-1的NaOH溶液滴定.在消耗NaOH溶液 42.00mL和50.00mL时各有一个滴定终点.请回答: