题目内容
20.某固体混合物可能含有Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2、NaCl中的一种或几种,现对该混合物做如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积):下列说法不正确的是( )
| A. | 混合物中一定不存在FeCl2和NaCl | |
| B. | 反应④的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ | |
| C. | 混合物中一定含有Al、(NH4)2SO4、MgCl2三种物质,无法判断是否含有AlCl3 | |
| D. | 白色沉淀5.80g是Mg(OH)2 |
分析 根据生成气体通过碱石灰体积不变(无酸性气体),而通过浓硫酸体积减小,说明剩余的 6.72 L气体为氢气,即原固体中一定含有金属Al,且其质量为$\frac{6.72L}{\frac{22.4L/mol}{1.5}}$×27 g/mol=5.4 g.生成氨气的物质的量为$\frac{11.2L-6.72L}{22.4L/mol}$=0.2 mol,则原固体中一定含有 0.1 mol (NH4)2SO4,其质量为13.2 g,得到白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,则说明5.8 g白色沉淀为Mg(OH)2,为0.1 mol,则固体中MgCl2为0.1 mol,质量为9.5g,无色溶液中有Al与过量NaOH溶液反应后得到的NaAlO2,根据Al、(NH4)2SO4和MgCl2的质量和判断是否含有AlCl3、NaCl.
解答 解:A.白色沉淀久置不变色,说明无FeCl2(氢氧化亚铁易被氧化为红棕色的氢氧化铁),28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,
5.4 g+13.2 g+9.5 g=28.1g,即原固体中一定不含有NaCl,故A正确;
B.28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,与过量NaOH溶液反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,最后无色溶液为NaAlO2、Na2SO4、NaCl、NaOH混合液,加适量的稀盐酸,所以反应④是偏铝酸根与氢离子反应生成氢氧化铝沉淀,AlO2-+H++H2O=Al(OH)3↓,故B正确;
C.28.1g固体中:含有金属Al:5.4 g,(NH4)2SO4:13.2 g,MgCl2:9.5g,5.4 g+13.2 g+9.5 g=28.1g,即原固体中一定不含有NaCl、AlCl3,故C错误;
D.因为NaOH过量,所以白色沉淀不可能含有氢氧化铝,MgCl2+2NaOH=Mg(OH)2↓+2NaCl,则说明5.8 g白色沉淀为Mg(OH)2,故D正确;
故选C.
点评 本题考查物质的分离、提纯以及检验,侧重于元素化合物知识的综合应用,为高考常考查题型,注意根据相关数据进行判断,题目难度中等.


反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按 如下流程分离产品:

已知:
| 沸点℃ | 密度g/cm3 | 溶解性 | |
| 溴 | 59 | 3.119 | 水中溶解度小,易溶于有机溶剂 |
| 苯 | 80 | 0.8765 | 难溶于水,与有机溶剂互溶 |
| 溴苯 | 156 | 1.50 | 难溶于水,与有机溶剂互溶 |
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)“水洗”主要目的是除去FeBr3,“NaOH溶液洗”主要目的是除去Br2.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子是Br-、H+,请设计实验方案验证你的推测.(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | 将锥形瓶中液体转入分液漏斗,加入适量四氯化碳,振荡后分液.分别取少量上层无色溶液于试管A、B中 | ||
| 2 | 锥形瓶中液体含大量 Br- | ||
| 3 | 锥形瓶中液体含大量 H+ |
①浙大研制的石墨烯弹性气凝胶(又名碳海绵)入选2013年度世界最轻固体材料
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现
③中科大最近成功发现了一种新的铁基超导材料 (Li0.8Fe0.2)OHFeSe(Se呈-2价)
④瑞典皇家理工学院(KTH)的研究人员已经成功的构建出了一种使水快速分解成氧气的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 雾霾中含有大量的PM2.5,PM2.5又称为“细颗粒物”,它容易附着有毒有害物质,尤其是重金属,对人体造成危害 | |
| C. | 新的铁基超导材料中Fe的化合价呈+2、+3价 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
| A. | 稀盐酸 | B. | 溴水 | C. | 酸性高锰酸钾 | D. | 氯化铁溶液 |
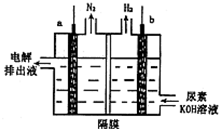 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
| A. | 常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S042-) | |
| B. | 相同温度下,0.2 mo I•L-1乙酸溶液与0.1 mo I•L-1乙酸溶液中,c(H+)之比 | |
| C. | Na2C03溶液中,c(Na+):c(C032-) | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
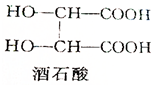 酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.
酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.