题目内容
1.NA表示阿伏加德罗常数,下列有关叙述正确的是( )①1mol苯乙烯中含有的碳碳双键数为4NA
②6.2g氧化钠和7.8g过氧化钠的混合物中含有的离子总数为0.6NA
③3.4gNH3中含N-H键数目为0.2NA
④常温下1L 0.5mol•L-1 NH4Cl溶液与2L 0.25mol•L-1 NH4Cl溶液所含NH4+的物质的量相同
⑤在标准状况下,22.4L 甲烷与18g水所含有的电子数均为10NA
⑥0.1mol的2H35Cl分子中的中子数是2NA
⑦1mol铁粉在1mol氯气中充分燃烧,失去的电子数为3NA
⑧1mol 固体NaHSO4含有的阴阳离子总数为2NA.
| A. | ②⑤⑧ | B. | ①④⑦ | C. | ②⑤⑥⑧ | D. | ①②⑤⑥ |
分析 ①苯环不是单双键交替的结构;
②过氧化钠中阴离子为过氧根离子,氧化钠与过氧化钠的物质的量都是0.1mol氧化钠和0.1mol过氧化钠中含有0.6mol阴阳离子;
③氨气分子中含有3个氮氢键,3.4g氨气的物质的量为0.2mol,含有0.6mol氮氢键;
④浓度越大水解程度越小;
⑤根据微粒数和宏观量之间的关系公式:N=nNA=$\frac{m}{M}$NA=$\frac{V}{{V}_{m}}$NA来计算;
⑥1mol2H35Cl中含19mol中子;
⑦先判断铁与氯气过量情况,然后根据不足物质的物质的量计算出转移的电子数;
⑧硫酸氢钠固体中含有的阳离子为钠离子、阴离子为硫酸氢根离子.
解答 解:①苯环不是单双键交替的结构,即苯环中不含双键,故1mol苯乙烯中含1mol双键,即NA个,故错误;
②6.2g氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol阴离子,总共含有0.3mol离子;7.8g过氧化钠的物质的量为0.1mol,含有0.2mol钠离子、0.1mol过氧根离子,总共含有0.3mol离子,二者的混合物中含有0.6mol离子,含有的离子总数为0.6NA,故正确;
③3.4g氨气的物质的量为:$\frac{3.4g}{17g/mol}$=0.2mol,0.2mol氨气分子中含有氮氢键的物质的量为:0.2mol×3=0.6mol,含N-H键数目为0.6NA,故错误;
④浓度越大水解程度越小,1L 0.50mol•L-1 NH4Cl溶液与2L 0.25mol•L-1 NH4Cl溶液含NH4+物质的量后者小,故错误;
⑤在标准状况下,22.4L甲烷含有的电子数=$\frac{22.4L}{22.4L/mol}$×(6+4)NA=10NA,18g水所含有的电子数=$\frac{18g}{18g/mol}$×(8+2)NA=10NA,故正确;
⑥1mol2H35Cl中含19mol中子,故错误;
⑦1mol铁与氯气完全反应生成1mol氯化铁,需要消耗1.5mol氯气,显然氯气不足,二者完全反应失去了2mol电子,失去的电子数为2NA,故错误;
⑧1mol硫酸氢钠中含有1mol钠离子和1mol硫酸氢根离子,含有离子总物质的量为2mol,含有的阴阳离子总数为2NA,故正确;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

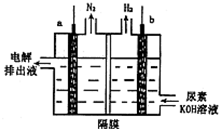 电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )
电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,a、b极均为惰性电极).下列说法正确的是( )| A. | 电解时,b极是阴极放出H2,发生氧化反应 | |
| B. | 溶液中OH-逐渐向b极移动 | |
| C. | 电解时,a极的电极反应式为:CO(NH2)2+8OH--6e═CO32-+N2↑+6H2O |
| A. | 若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX<HY | |
| B. | 若a=b,并测得c(X-)=c(Y-)+c(HY),则相同浓度时,酸性HX>HY | |
| C. | 若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY | |
| D. | 若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1mol/L,则可推出a=b=0.1 mol/L |
| A. | 青石棉可能是一种硅酸盐 | |
| B. | 青石棉中含有一定量的石英晶体 | |
| C. | 青石棉能和18molHNO3反应 | |
| D. | 青石棉的化学组成可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O |
| A. | 1,2,3-丙三醇 | B. | 1-甲基-5-乙基苯 | ||
| C. | 3-甲基-2-乙基戊烷 | D. | 2-甲基-1,3-丁二烯 |
| A. | 常温下,氨水与(NH4)2SO4溶液混合后pH=7的溶液中,c(NH4+):c(S042-) | |
| B. | 相同温度下,0.2 mo I•L-1乙酸溶液与0.1 mo I•L-1乙酸溶液中,c(H+)之比 | |
| C. | Na2C03溶液中,c(Na+):c(C032-) | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中,c[Ba(OH)2]:c(KOH) |
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,11.2 LNH3中含有的电子数为5NA | |
| D. | 常温常压下,22.4L氯气与足量铁粉充分反应,转移的电子数为2NA |
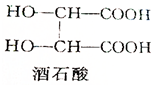 酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.
酒石酸的结构简式如图所示,它是葡萄酒中主要的有机酸之一,其主要用途是作饮料添加剂.写出酒石酸的分子式C4H6O6.