题目内容
7.钠、镁、铝三种金属单质的混合物跟足量的稀硫酸溶液充分反应后,得到标准状况下的氢气2.24L,则这三种金属的总物质的量可能是( )| A. | 0.050 mol | B. | 0.060 mol | C. | 0.100 mol | D. | 0.200 mol |
分析 根据电子转移守恒计算生成2.24L得到需要Na、Mg、Al的物质的量,再结合极限法进行判断.
解答 解:2.24L氢气物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据电子转移守恒生成2.24L氢气:需要Na的物质的量为$\frac{0.1mol×2}{1}$=0.2mol,需要Mg的物质的量为$\frac{0.1mol×2}{2}$=0.1mol,需要Al的物质的量为$\frac{0.1mol×2}{3}$≈0.067mol,故金属的物质的量介于0.067mol到0.2mol之间,故选C.
点评 本题考查化学方程式有关计算,侧重考查分析思维能力,注意利用电子转移守恒与极限法解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 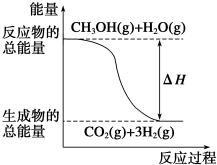 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ•mol-1 |
15.有关氨的说法不正确的是( )
| A. | NH3是4核10电子的分子,三角锥形,具有还原性 | |
| B. | NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂 | |
| C. | 氨气是非电解质,氨水是电解质 | |
| D. | 氨分子中氮原子最外层电子数为8 |
2.某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO 25%,密度为1.19g/cm3的消毒液.下列说法正确的是( )
| A. | 配制过程只需要三种仪器即可完成 | |
| B. | 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 | |
| C. | 所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 | |
| D. | 需要称量的NaClO固体的质量为140 g |
19.下列实验操作与实验目的相对应的是( )
| A. | 实验操作:制乙炔用饱和食盐水代替水,实验目的:加快化学反应速率 | |
| B. | 实验操作:C2H4与SO2混合气体通过盛有溴水的洗气瓶,实验目的:除去C2H4中的SO2 | |
| C. | 实验操作:淀粉溶液水解后冷却至温室,加碘水观察现象,实验目的:检验淀粉是否水解完全 | |
| D. | 实验操作:将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液,实验目的:检验溴乙烷中的溴原子 |
16.常温下,下列水溶液pH<7的是( )
| A. | Na2CO3 | B. | NH4Cl | C. | NaCl | D. | Na2SO4 |
17.已知短周期元素的离子 aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数 d>c>b>a | B. | 原子半径 A>B>D>C | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |