题目内容
2.欲配制100mL 0.1mol/L的盐酸,需2mol/L的盐酸多少毫升?配制后的盐酸的pH为多少?分析 根据稀释定律,稀释前后溶质的物质的量不变,据此计算需2mol/L的盐酸的体积;根据pH=-lgc(H+)计算溶液pH.
解答 解:设需要2mol/L的盐酸V毫升,根据稀释定律,稀释前后溶质的物质的量不变,则:
100mL×0.1mol/L=V mL×2mol/L,
解得V=5.0,
0.1mol/L的盐酸中c(H+)=0.1mol/L,则pH=-lgc(H+)=-lg0.1=1,
答:需2mol/L的盐酸5毫升,配制后的盐酸的pH为1.
点评 本题考查物质的量浓度有关计算、pH计算,比较基础,注意对物质的量浓度定义式的理解与灵活应用.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
13.2011年3月11日,日本发生地震,引起核泄漏,放射性物质${\;}_{53}^{131}I$进入大气.${\;}_{53}^{131}I$原子核内中子数是( )
| A. | 53 | B. | 78 | C. | 131 | D. | 184 |
10.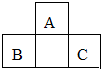 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | B、Mg、Si | D. | O、P、Cl |
17.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 42g乙烯和丙烯的混合气体充分燃烧消耗氧气的分子数为4.5 NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
7.下列有关阿伏伽德罗常数(NA)的说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
14.常温、常压下,体积相同的甲、乙两容器,甲中充满NH3,乙中充满H2和N2的混合气体,若两个容器内的气体密度相同,则下列判断正确的是( )
①两容器内原子总数相同 ②两容器内分子总数相同
③乙中N(H2):N(N2)=3:1 ④两容器内N(H):N(N)=3:1.
①两容器内原子总数相同 ②两容器内分子总数相同
③乙中N(H2):N(N2)=3:1 ④两容器内N(H):N(N)=3:1.
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | 只有② |
16.下列指定的微粒的个数比为2:1的是( )
| A. | BaO2(过氧化钡)固体中的阳离子和阴离子 | |
| B. | ${\;}_{1}^{2}$H中的中子和质子 | |
| C. | NaHCO3中的阳离子和阴离子 | |
| D. | 4Be2+中的质子和电子 |