题目内容
【题目】某化学兴趣小组进行以下实验探究:

Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
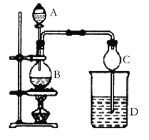
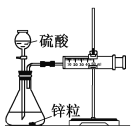
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |
【答案】短大基本相同气密性良好测定单位时间内产生H2的体积;(测定一段时间内H+的浓度变化;测定一定时间内锌粒质量变化)(任意一条即可)298粗颗粒1.003082.00298细颗粒2.00③④
【解析】
Ⅰ.(2) 稀硫酸和Zn可发生置换反应产生氢气,而气体产生在溶液中会以气泡的形式散发出来,故有气泡产生;反应物浓度越大,反应速率越快,所用时间就越短,即4mol·L-1的硫酸与锌反应速率较快,故(2)所用时间比(1)短 ;实验结论:4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率大;注意事项:① 固体表面积影响反应速率,锌粒的颗粒(即表面积)大小基本相同; ② 40 mL的硫酸要迅速加入;③ 检查装置气密性,装置不漏气,且计时要迅速准确;④ 气体收集可以用排水量气装置代替。实验讨论:测定实验的一些变量之间关系时一般可采用控制变量法,如控制时间相同,测定单位时间内产生氢气的体积;或测定一段时间内氢离子浓度变化;或测定一段时间内锌粒的质量变化;综上所述,本题答案是:短,大,基本相同,气密性良好;测定单位时间内产生H2的体积;(测定一段时间内H+的浓度变化;测定一定时间内锌粒质量变化)(任意一条即可)。
Ⅱ. 本实验是由实验①做对比实验探究影响反应速率的因素,所以在设计分组实验时,要设计出分别只有浓度、温度和接触面积不同时反应速率的变化,从而找出不同外界因素对反应速率的影响;
由于实验①②的温度、大理石规格相同,实验①和实验②探究的是HNO3浓度对该反应速率的影响,所以温度为298 K,大理石为粗颗粒,HNO3浓度为1.00 mol·L-1;
实验①③中只有温度不同,实验①和实验③就可以探究温度对该反应速率的影响,故实验③的温度选择308K;硝酸选2.00 mol·L-1;
实验①④中只有大理石规格不同,实验①和实验④可以探究接触面积对该反应速率的影响,故实验④选择细颗粒的大理石,温度为298,硝酸选2.00 mol·L-1;
综上所述,本题答案是:298 ,粗颗粒, 1.00, 308 , 2.00 , 298 , 细颗粒, 2.00,③,④。

【题目】依据题意,完成下列各题:
(1)1.0 g乙醇完全燃烧生成液态水放出1.37 kJ热量,表示乙醇的燃烧热的热化学方程式为__________________________________________________;
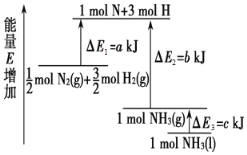
(2) “长征”2号火箭的发动机中用“偏二甲肼”(分子式为C2H8N2)和四氧化二氮作为液态燃料。已知a g偏二甲肼与b g四氧化二氮在发动机内燃烧生成稳定的、对环境友好的物质。若生成1 mol N2(g) 的反应热为c kJ,写出热化学方程式______________________________________________;
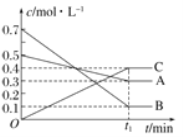
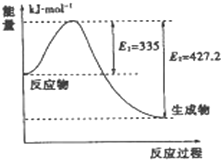
(3) T ℃时,如图所示, 对应的化学方程式为______________________;
(4) 向足量的H2SO4溶液中加入100 mL 0.4 mol·L-1的Ba(OH)2溶液,放出的热量是5.12 kJ。向足量的Ba(OH)2溶液中加入100 mL 0.4 mol·L-1的HCl溶液,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为Ba2+(aq)+SO42-(aq)===BaSO4(s) ΔH=______________;
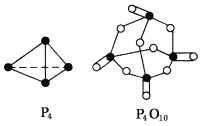
(5) 研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单地理解为断开1 mol化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P—P | P—O | O==O | P==O |
键能kJ/mol | 197 | 360 | 499 | x |
已知白磷(P4)的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物(P4O10)的结构如图所示,则上表中x=_________________。