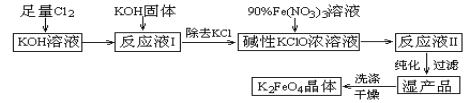
题目内容
【题目】根据图示回答问题:
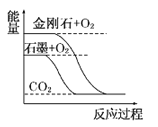
(1)化学反应N2+3H2===2NH3的能量变化如图所示,该反应的热化学方程式是______(填字母)。
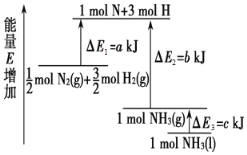
A.N2(g)+3H2(g)===2NH3(l)ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g)ΔH=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)===NH3(l)ΔH=(b+c-a) kJ·mol-1
D.1/2N2(g)+3/2H2(g)===NH3(g)ΔH=(a+b)kJ·mol-1
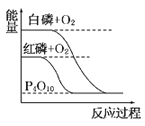
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为__________________________。
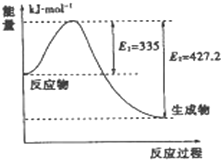
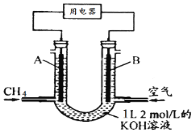
(3)2SO2(g)+O2(g)===2SO3(g)反应过程的能量变化如图所示。
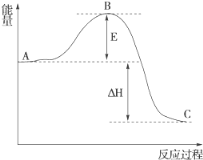
已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?___________________________________。
②图中ΔH=________kJ·mol-1。
【答案】A46.1 kJ反应物总能量生成物总能量无影响-198
【解析】
(1)由图可以看出,1/2molN2(g)+3/2molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,
所以1/2N2(g)+3/2H2(g)=NH3(g)ΔH=(a-b) kJ·mol-1;
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:1/2N2(g)+3/2H2(g)=NH3(l)ΔH=(a-b-c) kJ·mol-1,
即:N2(g)+3H2(g)=2NH3(l)ΔH=2(a-b-c)kJ·mol-1;.
综上所述,本题应选A;
(2)由题图可知生成2 mol NH3放出热量为427.2 kJ-335 kJ=92.2 kJ,则生成1 mol NH3放出热量为46.1 kJ;
(3)由图示可知,A表示反应物总能量,C表示生成物总能量,E值不影响A、C的能量值。故能量E的大小对该反应的反应热无影响。
②ΔH对应2 mol SO2(g)转化为2 mol SO3(g)的焓变,其值为2×(-99 kJ·mol-1)=-198 kJ·mol-1。

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组进行以下实验探究:
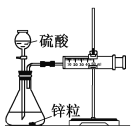

Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
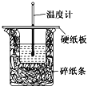
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |