题目内容
【题目】下列离子方程式书写正确的是
A. 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
B. 用惰性电极电解AlCl3溶液产生白色沉淀:2Al3++6Cl-+6H2O![]() Al(OH)3↓+3H2↑+3Cl2↑
Al(OH)3↓+3H2↑+3Cl2↑
C. 用酸性K2Cr2O7溶液检验酒精:3CH3CH2OH+2Cr2O72-+2H2O=4Cr(OH)3↓+3CH3COO-+OH-
D. 用足量的氨水处理硫酸工业的尾气:SO2+NH3·H2O=NH4++HSO3-
【答案】B
【解析】
A.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,明矾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O,故A错误;
B.用惰性电极电解AlCl3溶液,阴极周围的氢离子放电,产生氢氧根离子与铝离子反应生成氢氧化铝白色沉淀,方程式为2Al3++6Cl-+6H2O![]() 2Al(OH)3↓+3H2↑+3Cl2↑,故B正确;
2Al(OH)3↓+3H2↑+3Cl2↑,故B正确;
C.用酸性K2Cr2O7溶液检验酒精,生成的醋酸不能拆开,正确的离子方程式为:3CH3CH2OH+2Cr2O72-+16H+=4Cr3++11H2O+3CH3COOH,故C错误;
D.用足量的氨水处理硫酸工业的尾气,反应生成亚硫酸铵,正确的离子方程式为:SO2+2NH3H2O=2NH4++SO32-,故D错误;
答案选B。

【题目】某化学兴趣小组进行以下实验探究:
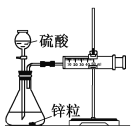

Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |

