题目内容
【题目】按以下步骤从![]() 合成
合成![]() 。(部分试剂和反应条件已略去)
。(部分试剂和反应条件已略去)
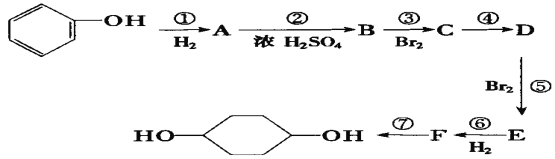
请回答下列问题:
(1)分别写出B、D的结构简式:B_________、D_________。
(2)反应①~⑦中属于消去反应的是_______________。(填数字代号)
(3)如果不考虑⑥、⑦反应,对于反应⑤,得到的E可能的结构简式为______________________ 、_____________________、_____________________。
(4)写出下列反应的化学方程式(并注明反应条件) A→B _________;C→D____________。
【答案】![]()
![]() ②④
②④ 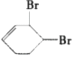
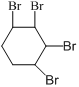
![]()
![]()
![]()
![]() +H2O
+H2O 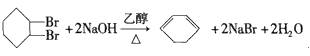
【解析】
![]() 与氢气发生加成反应可生成A为
与氢气发生加成反应可生成A为![]() ,环己醇在浓硫酸作用下发生消去反应生成B为
,环己醇在浓硫酸作用下发生消去反应生成B为![]() ,环己烯与溴发生加成反应生成C为
,环己烯与溴发生加成反应生成C为![]() ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D(
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D(![]() ),
),![]() 与溴发生1,4-加成生成E为
与溴发生1,4-加成生成E为![]() ,
,![]() 与氢气发生加成反应生成F为
与氢气发生加成反应生成F为![]() ,F在氢氧化钠水溶液、加热条件下发生水解反应生成
,F在氢氧化钠水溶液、加热条件下发生水解反应生成![]() ,以此来解答。
,以此来解答。
(1)由以上分析可知B为![]() ,D为
,D为![]() ,故答案为:
,故答案为:![]() ,
,![]() 。
。
(2)根据以上反应关系可知①为加成反应,②为消去反应,③为加成反应,④为消去反应,⑤为加成反应,⑥为加成反应,⑦为取代反应,则属于消去反应为的为②④,故答案为:②④。
(3)不考虑反应条件,步骤⑤通过加成反应得到的产物E,![]() 可与溴1:1加成有2种产物(1,2加成方式或1,4加成方式),结构简式为:
可与溴1:1加成有2种产物(1,2加成方式或1,4加成方式),结构简式为: 、
、 ;或生成与溴1:2加成有1种产物,结构简式为:
;或生成与溴1:2加成有1种产物,结构简式为: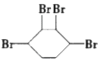 ,
,
故答案为: ,
, ,
, 。
。
(4)步骤②“A→B”的化学方程式为![]()
![]()
![]() +H2O,步骤④“C→D”的化学方程式为
+H2O,步骤④“C→D”的化学方程式为 ,故答案为:
,故答案为:![]()
![]()
![]() +H2O,
+H2O, 。
。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
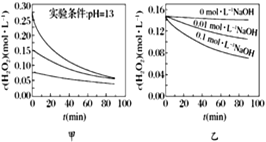
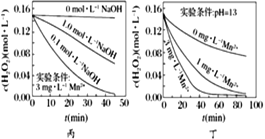
波波熊暑假作业江西人民出版社系列答案【题目】某化学兴趣小组进行以下实验探究:


Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |