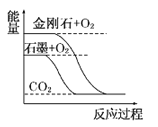
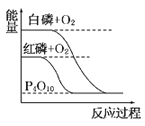
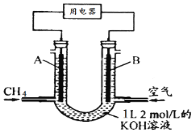
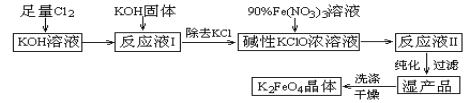
题目内容
【题目】某校活动小组为探究金属腐蚀的相关原理,设计了如下图a所示装置,图a的铁棒末段分别连上一块Zn片和Cu片,并静置于含有K3[Fe(CN)6]及酚酞的混合凝胶上。一段时间后发现凝胶的某些区域(如下图b所示)发生了变化。已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)。则下列说法错误的是

A. 甲区发生的电极反应式:Fe-2e-=Fe2+ B. 乙区产生Zn2+
C. 丙区呈现红色 D. 丁区呈现蓝色
【答案】A
【解析】
A、铁棒末端连上Zn片时,Zn片端(乙区)作负极,乙区的电极反应为Zn-2e-=Zn2+;铁棒另一端(甲端)作正极,甲区的电极反应为O2+2H2O+4e-=4OH-,A错误;
B、乙区的电极反应为Zn-2e-=Zn2+,因此乙区产生Zn2+,B正确;
C、铁棒末端连上Cu片时,Cu片端(丙区)作正极,丙区的电极反应为O2+2H2O+4e-=4OH-,溶液呈碱性,酚酞变红,C正确;
D、铁棒另一端(丁区)作负极,丁区的电极反应为:Fe-2e-=Fe2+,遇K3Fe(CN)6呈现蓝色,D正确。
答案选A

【题目】某化学兴趣小组进行以下实验探究:
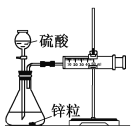

Ⅰ. 设计实验探究反应速率的测定和比较
实验步骤:
(1)取一套装置(装置如图所示),加入40 mL 1 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
(2)取另一套装置,加入40 mL 4 mol·L-1的硫酸,测量收集10 mL H2所需的时间。
实验现象: 锌跟硫酸反应产生气泡,收集10 mL气体,(2)所用时间比(1)所用时间________(填“长”或“短”);
实验结论: 4 mol·L-1硫酸与锌反应比1 mol·L-1硫酸与锌反应速率______(填“大”或“小”)。
注意事项:① 锌粒的颗粒(即表面积)大小________________;
② 40 mL的硫酸要迅速加入;
③ 装置____________________,且计时要迅速准确;
④ 气体收集可以用排水量气装置代替。
实验讨论:除本实验测定反应速率的方法外,可行的方案还有(任写一种)
________________________________________________________________。
Ⅱ. 探究用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素,所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K。
请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T(K) | 大理石规格 | HNO3浓度 (mol·L-1) | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (1)实验①和②探究HNO3浓度对该反应速率的影响 (2)实验①和_____探究温度对该反应速率的影响 (3)实验①和_____探究大理石规格(粗、细)对该反应速率的影响 |
② | _____ | ________ | _________ | |
③ | _____ | 粗颗粒 | _________ | |
④ | ______ | ______ | ________ |
【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%