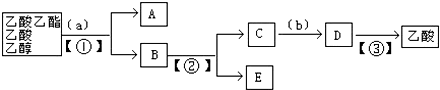
题目内容
8.某饱和一元醇和一元醛的混合物共3g,跟足量的银氨溶液完全反应后,可还原出16.2gAg,下列说法正确的是( )| A. | 一定是甲醛 | B. | 可能是乙醛 | ||
| C. | 混合物中二者的质量比是1:3 | D. | 不可能有此种醛 |
分析 醇不能与银氨溶液反应,假设3g都是除甲醛外的醛,则反应关系式为:R-CHO~2Ag,再根据M=$\frac{m}{n}$计算该醛的摩尔质量,实际醛的摩尔质量应小于假设计算值,据此判断醛成分,若为甲醛,则关系式为:HCHO~4Ag,结合关系式计算醛的物质的量,根据m=nM计算醛的质量,进而计算醇的质量.
解答 解:16.2gAg的物质的量为:$\frac{16.2g}{108g/mol}$=0.15mol,
假设3g都是除甲醛外的醛,则R-CHO~2Ag,故R-CHO的物质的量=0.15mol×$\frac{1}{2}$=0.075mol,
故R-CHO的摩尔质量为:$\frac{3g}{0.075mol}$=40g/mol,而除甲醛外最简单的醛是乙醛,乙醛摩尔质量为44g/mol,大于40g/mol,
故该醛一定为HCHO,
甲醛发生银镜反应,存在关系:HCHO~4Ag,则甲醛物质的量为0.15mol×$\frac{1}{4}$,故HCHO的质量=0.15mol×$\frac{1}{4}$×30g/mol=1.125g,故醇的质量=3g-1.125g=1.875g,则混合物中醇和醛的质量比为:1.875g:1.125g=5:3,故C错误;
由上述分析可知,A正确,BCD错误,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,利用反证法确定含有的醛是解题的关键,试题侧重考查学生分析解决问题的能力及化学计算能力.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案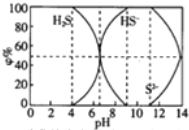
| A. | 当c(HS-)>c(S2-)时,溶液一定显酸性 | |
| B. | 当pH=7时,溶液中有c(Na+)=c(HS-)+2c(S2-)+c(H2S) | |
| C. | 当4<pH时,向其中滴加0.1mol/L CuSO4都有CuS沉淀(Kφ(CuS)=6.3×10-36) | |
| D. | 当pH=9时,溶液中有c(H+)=c(OH-)+c(HS-) |
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、N03- | |
| C. | 通入足量CO2的溶液:H+、NH4+、Al3+、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
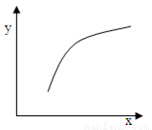
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
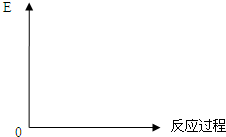 Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应
Ⅰ、试分析比较合成氨与用SO2和O2反应制SO3的反应