题目内容
9.能使酸性高锰酸钾溶液褪色而不能使溴水褪色的烃是( )| A. | CH2=CH-CH2-CH2-CH2-CH3 | B. | HC≡C-CH2-CH2-CH2-CH3 | ||
| C. |  | D. | 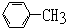 |
分析 碳碳不饱和键、醛基等都能被酸性高锰酸钾溶液氧化,醛基能被溴氧化,连接苯环的碳原子上含有氢原子的苯的同系物能被酸性高锰酸钾溶液氧化,据此分析解答.
解答 解:A.该分子中含有碳碳双键,能被酸性高锰酸钾溶液氧化而使其褪色,溴和碳碳双键发生加成反应而使溴水褪色,故A错误;
B.该分子中含有碳碳三键,能被酸性高锰酸钾溶液氧化而使其褪色,溴和碳碳双键发生加成反应而使溴水褪色,故B错误;
C.苯性质较稳定,不能被酸性高锰酸钾氧化,不和溴水反应,但能萃取溴水,所以能使溴水褪色,故C错误;
D.甲苯能被酸性高锰酸钾溶液氧化生成苯甲酸而使酸性高锰酸钾溶液褪色,但和溴水不反应,所以不能使溴水褪色,故D正确;
故选D.
点评 本题考查物质结构和性质,为高考高频点,明确物质中官能团及其性质是解本题关键,注意:并不是苯的同系物都能被酸性高锰酸钾氧化,为易错点.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
2.下列推论正确的是( )
| A. | S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完反应,放出的热量为28.7 kJ | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定 | |
| D. | 2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则碳的燃烧热等于 110.5 kJ/mol |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 通入过量SO2气体后的溶液:H+、Ca2+、Fe3+、N03- | |
| C. | 通入足量CO2的溶液:H+、NH4+、Al3+、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
17.向200mL 18mol/L H2SO4溶液中加入足量的铜片,加热使之反应,则充分反应后,被还原的H2SO4的物质的量可能是( )
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
1.下列关于离子化合物的叙述错误的是( )
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 在熔融状态下可以导电的化合物一定是离子化合物 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
18.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
| A. | K+ MnO4- Cl- SO42- | B. | Na+ AlO2- Cl- SO42- | ||
| C. | SO42-Na+ HCO3-Ba2+ | D. | Na+ NO3- NH4+ SO42- |
19.随着碱金属、卤素原子半径的增大,下列递变规律正确的是( )
| A. | 碱金属和卤素单质的熔沸点都逐渐降低 | |
| B. | 碱金属和卤素单质的密度都依次变大 | |
| C. | 卤素的气态氢化物稳定性逐渐增强 | |
| D. | 碱金属单质还原性逐渐增强 |
 .
.