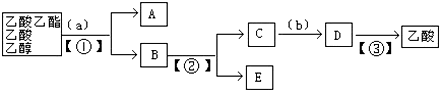
题目内容
19.下列化学式中,具有非极性键的离子化合物是( )| A. | H2O2 | B. | MgF2 | C. | NaOH | D. | Na2O2 |
分析 含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.双氧水分子中H-O原子之间存在极性键、O-O原子之间存在非极性键,属于共价化合物,故A错误;
B.氟化镁中镁离子和氟离子之间只存在离子键,属于离子化合物,故B错误;
C.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,属于离子化合物,故C错误;
D.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,属于离子化合物,故D正确;
故选D.
点评 本题考查化学键和化合物的关系,明确物质的构成微粒及物质之间作用力即可解答,熟练掌握常见化合物中存在的化学键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
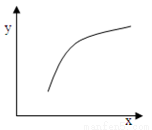
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
7.下列物质的说法不正确的是( )
| A. | 天然气的主要成份是乙烯,芳香烃主要来自于煤的干馏后的煤焦油 | |
| B. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是德国化学家李比希 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏和石油的催化裂化 | |
| D. | 乙烷、丙烷中的化学键既有极性键又有非极性键 |
4.铅蓄电池工作时反应的化学方程式为Pb+PbO2+2H2SO4═2PbSO4+H2O.下列关于该电池的说法正确的是( )
| A. | 铅蓄电池电池是一次电池 | |
| B. | 负极反应式为Pb-2e-═Pb2+ | |
| C. | 连续工作后电解液的酸性将减小 | |
| D. | 工作中,每转移0.2 mol电子时,负极质量减少6.5 g |
11.某化合物由C、H两种元素组成,其中含碳的质量分数85.7%,在标准状况下,11.2L此化合物气体的质量为14g.则此化合物的分子式为( )
| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
8.下列实验能达到目的是( )
| A. | 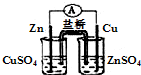 构成锌-铜原电池 | B. |  碘的CCl4溶液中分离I2并回收CCl4 | ||
| C. | 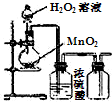 制取O2 | D. | 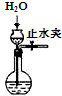 检查装置气密性 |
9.下表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑧元素组成的分子的电子式: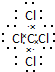 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
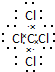 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子
 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题). 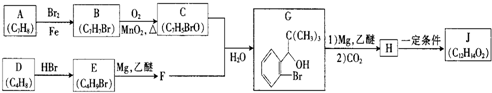
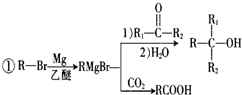
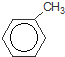 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$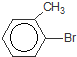 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应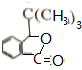
 .
.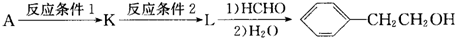
 .
.