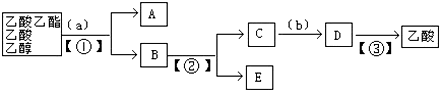
题目内容
4.下列说法正确的是( )①一块冰中氢、氧原子间只以化学键相结合
②金属和非金属化合形成离子键
③离子键是阳离子、阴离子的相互吸引
④双原子单质分子中的共价键一定是非极性键
⑤非金属原子间不可能形成离子键
⑥离子化合物中可能有共价键
⑦共价化合物中可能有离子键
⑧两种不同非金属元素形成的共价化合物中只有极性键.
| A. | ④⑥ | B. | ②④⑤ | C. | ①②③ | D. | ④⑥⑧ |
分析 ①冰中,分子内H-O原子之间存在极性键,分子间H-O原子之间存在氢键;
②金属和非金属化合可能形成共价键;
③离子键是阳离子、阴离子的相互作用;
④同种非金属元素之间易形成非极性键;
⑤非金属原子间可能形成离子键;
⑥离子化合物中可能有共价键,一定含有离子键;
⑦共价化合物中只含共价键,一定不含离子键;
⑧两种不同非金属元素形成的共价化合物中有极性键,可能含有非极性键.
解答 解:①冰中,分子内H-O原子之间存在极性键,分子间H-O原子之间存在氢键,所以冰中氢、氧原子间存在极性键和氢键,故错误;
②金属和非金属化合可能形成共价键,如氯化铝中只含共价键,故错误;
③离子键是阳离子、阴离子的相互作用,相互作用包含吸引力和排斥力,故错误;
④同种非金属元素之间易形成非极性键,所以双原子单质分子中的共价键一定是非极性键,故正确;
⑤非金属原子间可能形成离子键,如铵盐,故错误;
⑥离子化合物中可能有共价键,一定含有离子键,如KOH,故正确;
⑦共价化合物中只含共价键,一定不含离子键,故错误;
⑧两种不同非金属元素形成的共价化合物中有极性键,可能含有非极性键,如过氧化氢、烃类有机物等,故错误;
故选A.
点评 本题考查化学键和化合物的关系,明确物质的构成微粒是解本题关键,注意规律中的反常现象,采用举例法分析解答,注意氢键不属于化学键,属于分子间作用力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是( )
| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
12.对如图装置的叙述错误的是( )
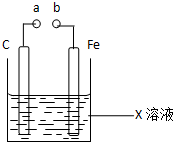

| A. | X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应 | |
| B. | X如果是CuSO4,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| C. | X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源的正、负极时,H+的移动方向均相同 | |
| D. | X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |
19.随着碱金属、卤素原子半径的增大,下列递变规律正确的是( )
| A. | 碱金属和卤素单质的熔沸点都逐渐降低 | |
| B. | 碱金属和卤素单质的密度都依次变大 | |
| C. | 卤素的气态氢化物稳定性逐渐增强 | |
| D. | 碱金属单质还原性逐渐增强 |
9.下表为元素周期表的一部分用元素符号或化学式回答下列问题.
(1)写出⑥与⑧元素组成的分子的电子式: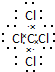 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ① | ⑦ | ④ | ||||
| 3 | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ⑨ |
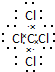 ,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.
,该分子含有极性(填“极性”或“非极性”)键. 26号Fe元素在元素周期表中的位置是第四周期ⅤⅢ族.(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为NH3+HNO3=NH4NO3;-
第三周期中除⑩元素以外离子半径最小的是Al3+(填离子符号).
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是KOH (填化学式),元素⑦的氢化物的结构式为H-O-H; 该氢化物和元素④单质反应的化学方程式为2F2+2H2O=4HF+O2.
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为Cl2+2Br-=2Cl-+Br2.在反应后的溶液中加入有机溶剂苯,震荡后静置的实验现象为溶液分层,上层为橙红色,下层为无色.
(5)②和⑧的最高价氧化物对应水化物分别与⑤的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O、Al(OH)3+3H+═Al3++2H2O;
(6)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子
 ;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
;该化合物与二氧化碳的方程式为2Na2O2+2CO2=2Na2CO3+O2;④⑧⑨元素的离子的还原性由强到弱顺序为Br->Cl->F-(用离子符号答题).
13.空气是人类生存所必需的重要资源,下列说法正确的是( )
| A. | 2009年11月,中国政府公布了温室气体减排的行动目标,减排气体是的指二氧化硫 | |
| B. | 氮氧化物排放会引起光化学污染而与酸雨无关 | |
| C. | 开发新能源、燃煤脱硫、安装汽车尾气转化器等措施可以减少酸雨 | |
| D. | 二氧化碳是无毒的气体,可以任意排放 |
10.(有机物体的表示方法、有机物的相互反应和同分异构体)观察下列模型,其中只有C、H、O三种原子,下列说法错误的是( )
| 序号 | 1 | 2 | 3 | 4 |
| 模型示意图 |  |  |  |  |
| A. | 模型1对应的物质的二氯代物有2种 | |
| B. | 模型2对应的物质的官能团是羧基 | |
| C. | 模型2对应的物质可与模型3对应的物质发生酯化反应 | |
| D. | 模型4对应的物质可以与氯气发生加成反应 |