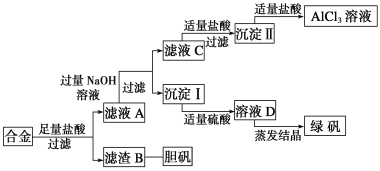
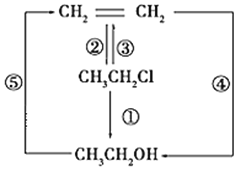
��Ŀ����
����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��______________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��________________________
��3������Һ����SO2�Ĺ����У�pH��n(SO3��):n(HSO3��)�仯��ϵ���±�:
n(SO��)��n(HSO��) | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ��______�ԣ��û�ѧƽ��ԭ�����ͣ�____________��
��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ)��____________
a��c��Na����=2c��SO32-����c��HSO3������
b��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH����
c��c��Na����+c��H����= c��SO32-��+ c��HSO3����+c��OH����
(4)������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�
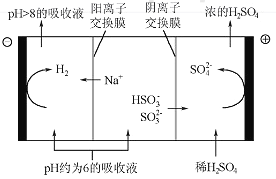
��HSO3-�������ŵ�ĵ缫��Ӧʽ��_______________��
��������������Һp������8����ʱ������Һ������ѭ�����á���������ԭ����__________
���𰸡�SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��
2H2SO4 SO2+2OH- =SO32-+H2O �� HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶� ab HSO3-+H2O-2e- =3H++SO42- H+�������õ�������H2����Һ�е�c��H�������ͣ���ʹHSO3-��������SO32-����Na+���������ң�����Һ��������
��������
��1��SO2�ڿ����б���������ΪSO3��SO3��ˮ��Ӧ�������ᣬҲ������SO2�Ⱥ�ˮ��Ӧ���������ᣬ�����ᱻ��������Ϊ���ᡣ
��2��������SO2��NaOH��Һ��Ӧ����Na2SO3��
��3������n(SO2-)��n(HSO-)=1:91ʱ��Һ��pH=6.2��֪NaHSO3��Һ�����ԣ�ԭ����HSO-�ĵ���̶ȴ�����ˮ��̶ȡ����ݵ���غ㡢�ͱ������ݿ��ж�Ũ�ȹ�ϵ��
(4)�����У�������HSO-ʧȥ��������SO42-��ͬʱ����H+������ϡ����Ũ��������������ˮ�����H+�õ�����������������Һ��OH-Ũ������HSO-��Ӧ����SO32-����Na+���������ң�ʹ����Һ����������
��1��SO2�γ�����������ʱ����������Ϳ����е�ˮ��������Ӧ�õ����SO2+H2O![]() H2SO3��2 H2SO3+O2
H2SO3��2 H2SO3+O2![]() 2H2SO4��
2H2SO4��
��2��������������������Һ�����Ʊ�����������Һʱ��SO2+2OH- =SO32-+H2O��
��3�����ݱ������ݣ���֪��n(SO3��):n(HSO3��)=1:91ʱ����Һ��pHֵΪ���ԣ���NaHSO3��Һ�����ԣ���������������Һ��HSO3�����ڣ�HSO3��![]() SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
SO32-+H����HSO3��+H2O=H2SO3+OH����HSO3���ĵ���̶�ǿ��ˮ��̶ȣ�����Һ�����ԡ�������Һ������ʱ����Һ�е�c��H����=c��OH������������Һ�д����ŵ���غ㣬��c��Na����+c��H����=2c��SO32-��+ c��HSO3����+c��OH���������Ƴ���c��Na����=2c��SO32-����c��HSO3������a��ȷ������n(SO��):n(HSO��)=1��1ʱ����Һ��pHֵΪ7.2��������ʱһ����c��HSO3����> c��SO32-�������Ƴ���c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH������b��ȷ��c�����ϵ���غ㡣��ѡab��
��4�����ݵ�����ʾ�ı仯����֪HSO3-�������ŵ�ĵ缫��Ӧʽ�ǣ�HSO3-+H2O-2e- =3H++SO42-��

 ��ĩ��ϰ���ϵ�д�
��ĩ��ϰ���ϵ�д� ����ѧ�䵥Ԫ������ĩר����100��ϵ�д�
����ѧ�䵥Ԫ������ĩר����100��ϵ�д� �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д�