题目内容
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________________________。利用反应6NO2+ 8NH3![]() 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___________L。
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
SO3(g)+NO(g)的 ΔH=_____________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,测得平衡时NO2与SO2体积比为1∶6,则平衡常数K=_______________。
【答案】3NO2+H2O===NO+2HNO3 6.72 -41.8 ![]()
【解析】
(1)NO2用水吸收,根据氧化还原反应中电子得失进行计算;
(2)根据可逆反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)结合三段式进行计算。
SO3(g)+NO(g)结合三段式进行计算。
(1)NO2用水吸收,反应方式为:3NO2+H2O=NO+2HNO3;在6NO2+8NH3![]() 7N2+12H2O反应中,NO2化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=
7N2+12H2O反应中,NO2化合价由+4→0,得到4e-,现在转移1.2mole-,即NO2 得到1.2mole-,所以n(NO2 )=![]() =0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
=0.3mol,所以标况下V(NO2)=0.3mol×22.4L/mol=6.72L;
(2)反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)可以由已知方程式(①+②)×
SO3(g)+NO(g)可以由已知方程式(①+②)×![]() 得到,所以ΔH=(ΔH1+ΔH2)×
得到,所以ΔH=(ΔH1+ΔH2)×![]() =-41.8kJ/mol;
=-41.8kJ/mol;
令NO2与SO2的起始物质的量分别为1mol、2mol,设平衡时参加反应的SO2的物质的量为xmol,则:
NO2(g)+SO2(g)SO3(g)+NO(g)
开始(mol):1 2 0 0
变化(mol):x x x x
平衡(mol):1-x 2-x x x
故(1-x):(2-x)=1:6,解得x=0.8,平衡常数K=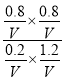 =
=![]() 。
。

【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuO | |
c | NaCl | Al(OH)3 | FeCl2 | CuSO4 |
A. A B. B C. C D. D
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
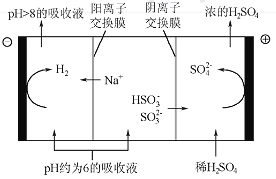
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________





