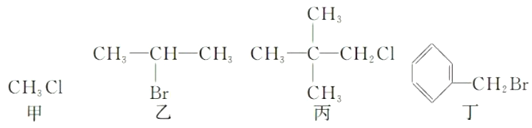
��Ŀ����
����Ŀ��ijѧУ��ѧ��ȤС��Ϊ̽��������������ۺ����ã�ר�����ʵ���ú�����������ͭ�ĺϽ���ȡ�������Ȼ�����Һ���̷�����(FeSO4��7H2O)�͵�������(CuSO4��5H2O)����ʵ�鷽�����£�
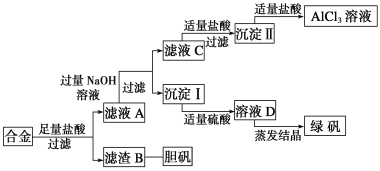
��ش��������⣺
(1)�����õIJ���������___________________________________________________��
(2)����ҺCת��Ϊ������Ĺ�������������������ƣ��ɸ�ΪͨCO2���壬д����ҺC��ͨ�����CO2�����ӷ���ʽ��______________________________________________��
д���ɳ�����ת��ΪAlCl3��Һ�����ӷ���ʽ��_____________________________��
(3)С���Ա������⣬�����Ƶõ��̷��������Է�������Ҫ������Щ���ʣ�_______________________________��Ҫ���ɳ����������Ƶô��Ƚϸߵ��̷���Ӧ��θĽ�___________________________________
(4)С���Ա�������л�֪H2O2��һ����ɫ��������������B�м���ϡ�����H2O2���Ʊ��������壬��÷�Ӧ���ܻ�ѧ����ʽΪ_______________________________��
(5)��ͬѧ����ɽ�����������ܽ�Ͻ�������Ϊ�ռ������Ʒ�����Ҳ�������Ƶ��������ʣ�����Ϊ�ڶ��ַ�������ڵ�һ�ַ���________(������������������������)��������________________________��
���𰸡��ձ���©���������� AlO2-��CO2��2H2O=Al(OH)3����HCO3- Al(OH)3��3H��=Al3����3H2O �Ȼ��ơ������ơ������� ����ҺD�м����������ۣ���Ӧ����ˣ��ٽ���Һ����Ũ������ȴ�ᾧ�����˼��ɵô��Ƚϸߵ��̷� Cu��H2O2��H2SO4��3H2O=CuSO4��5H2O(��Cu��H2O2��H2SO4=CuSO4��2H2O) ������ ǰһ�ַ�����������ࡢʱ�䳤�������Լ�����
��������
�Ͻ���������ͭ�������������ܽ����ˣ��õ���ҺAΪ�Ȼ������Ȼ�������������������������Һ���˵õ���ҺCΪƫ��������Һ����������������˵õ��������������������������������ܽ������Ȼ�����Һ��������Ϊ������������������������������������ҺD�����ᾧ�õ��̷����壻
(1)���ݹ���ʵ���õ����������ش�
(2)��ҺC�к���ƫ�����ƣ�ͨ�����CO2������������������̼�����ƣ�������Ϊ���������������ᷴӦת��ΪAlCl3��Һ��
(3)�Ƶõ��̷������������������ӱ�����Ϊ�����ӣ�Ҫ���ɳ���I�����Ƶô��Ƚϸߵ��̷�����Ҫ��D��Һ�м���������ۻ�ԭ�����ӹ��˺���Һͨ�������õ����壻
(4)ͭ��ϡ���ᡢ˫��ˮ���������жϷ�Ӧ�ķ���������������غ㶨��д���÷�Ӧ�Ļ�ѧ����ʽ��
(5)����ʵ���е���ͼ������������ԱȻش�
�Ͻ���������ͭ�������������ܽ����ˣ��õ���ҺAΪ�Ȼ������Ȼ�������������������������Һ���˵õ���ҺCΪƫ��������Һ����������������˵õ����������������������ܽ������Ȼ�����Һ��������Ϊ����������������������������������ҺD�����ᾧ�õ��̷����壻
(1)����ʵ���õ��������У���ֽ������̨����Ȧ���ձ�����������©�����ʴ�Ϊ���ձ���©������������
(2)��ҺC�к���ƫ�����ƣ�ͨ�����CO2������������������̼�����ƣ���Ӧ�����ӷ���ʽΪAlO2-+CO2+2H2O=Al(OH)3��+HCO3-��������Ϊ���������������ᷴӦת��ΪAlCl3��Һ����Ӧ�����ӷ���ʽΪAl(OH)3+3H+�TAl3++3H2O��
(3)�����Ƶõ��̷������������Ȼ��ơ������ơ�������������Ϊ�������ӱ�����Ϊ�����ӣ�Ҫ���ɳ���I�����Ƶô��Ƚϸߵ��̷�����Ҫ��D��Һ�м���������ۻ�ԭ������Ϊ�������ӣ����˵õ���Һ����Ũ������ȴ�ᾧ������ϴ�ӵõ��̷����壻
(4)ͭ��Ũ���ᷴӦ�����ж�����Ⱦ�Ķ����������壬��ͭ�Ⱥ�������Ӧ��������ͭ��Ȼ������ͭ������ᷴӦ��������ͭ�����������Ⱦ���������壬�ù���ԭ�������ʸߣ�����;������ѣ�Cu�м���ϡ�����H2O2�����Ʊ��������壬��Ӧ����ʽΪ��Cu+H2O2+H2SO4+3H2O�TCuSO45H2O(��Cu+H2O2+H2SO4�TCuSO4+2H2O��
(5)��ʵ��ԭ�����У���Ҫ�����������ᣬ�Ҳ��跱��������ѿ��ƣ������ռ���ȷ����������Ȼ��������ᣬ�������������ͭ�Ļ�����ʱȽϺ�����

 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�����Ŀ��ֱ���ŷź�SO2���������γ����꣬Σ�������������Ƽ�ѭ�������ѳ������е�SO2��
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��______________��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��________________________
��3������Һ����SO2�Ĺ����У�pH��n(SO3��):n(HSO3��)�仯��ϵ���±�:
n(SO��)��n(HSO��) | 91��9 | 1��1 | 1��91 |
pH | 8.2 | 7.2 | 6.2 |
���ϱ��ж�NaHSO3��Һ��______�ԣ��û�ѧƽ��ԭ�����ͣ�____________��
��������Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����(ѡ����ĸ)��____________
a��c��Na����=2c��SO32-����c��HSO3������
b��c��Na����> c��HSO3����> c��SO32-��>c��H����=c��OH����
c��c��Na����+c��H����= c��SO32-��+ c��HSO3����+c��OH����
(4)������Һ��pH����ԼΪ6ʱ����������������������ʾ��ͼ���£�
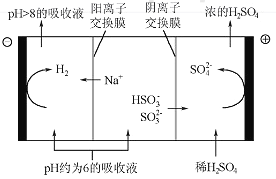
��HSO3-�������ŵ�ĵ缫��Ӧʽ��_______________��
��������������Һp������8����ʱ������Һ������ѭ�����á���������ԭ����__________
����Ŀ��X��Y��Z��WΪ���ֳ����Ķ�����Ԫ�ء�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ����ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��W�����ڱ���λ��___��
��2��X�����ܹ�����+1�������ӣ������ʽ��___��Y����̬�⻯���Z����̬�⻯��ķе�ߣ�Ե����___��
��3��X������������ˮ���������⻯���ܻ�������M��M�ľ�������Ϊ___��M��ˮ��Һ�����Ե�Ե����___(�����ӷ���ʽ��ʾ)��
��4����Y��Z�����һ����̬������Q��Q����W�ĵ����ڳ�ʪ�����з�Ӧ����Ӧ�Ļ�ѧ����ʽ��___��
����һ�������£�������Q��Y�ĵ��ʷ�Ӧ��ƽ��ʱ��������̬���ʣ���Ӧʱ��ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ��___��