题目内容
【题目】(1)有一包白色固体粉末可能为Na2CO3或NaHCO3其中的一种,请设计实验确定该白色粉末的成分________________________________________;
(2)某同学根据CO32-的性质用纯碱溶液、酚酞试剂、氯化钙溶液,设计了一个探究纯碱溶液呈碱性是由CO32--引起的实验方案,主要实验步骤及实验现象为:
① CO32-水解的离子反应方程式为____________________________________________;
② 取少量氯化钙溶液滴入酚酞,不变红色,说明:_____________________________;
③ 取少量碳酸钠溶液,滴入酚酞后显红色,再加入氯化钙溶液的现象为:____________________________。说明_____________________________________。
【答案】取少量固体于试管中进行加热,将产生的气体通入澄清的石灰水中,观察是否有白色沉淀生成,即可判断原固体是哪一种固体 CO32—+H2O![]() HCO3-+OH— 钙离子和氯离子不会引起溶液显碱性 产生白色沉淀,同时红色变浅,最终褪色 说明Na2CO3溶液碱性是由CO32—引起的
HCO3-+OH— 钙离子和氯离子不会引起溶液显碱性 产生白色沉淀,同时红色变浅,最终褪色 说明Na2CO3溶液碱性是由CO32—引起的
【解析】
(1)碳酸钠与氯化钡反应生成白色沉淀,而碳酸氢钠不能;也可以利用碳酸氢钠的不稳定性鉴别;
(2)碳酸根离子水解使碱性,而加氯化钙,生成白色沉淀,红色变浅,以此说明水解呈碱性;
①CO32-水解以第一步为主;
②氯化钙溶液为中性;
③碳酸钠溶液水解显碱性,加入氯化钙溶液,生成碳酸钙,水解平衡逆向移动,碱性降低。
(1)碳酸钠与氯化钡反应生成白色沉淀,而碳酸氢钠不能,发生的化学反应为Na2CO3+BaCl2═2NaCl+BaCO3↓,设计实验分别取少量溶于水,滴加氯化钡溶液生成白色沉淀的为Na2CO3,无现象的为碳酸氢钠;
或:取少量固体于试管中进行加热,将产生的气体通入澄清的石灰水中,观察是否有白色沉淀生成,即可判断原固体是哪一种固体。
(2)碳酸根离子水解使碱性,而加氯化钙,生成白色沉淀,红色变浅,以此说明水解呈碱性,所以实验步骤及实验现象为:用试管取少量碳酸钠溶液,滴入酚酞呈红色,再向溶液中滴入氯化钙溶液,产生白色沉淀,红色变浅并褪去,此时Na+仍存在于溶液中,说明溶液的碱性由CO32-引起,
①CO32-水解的离子反应方程式为:CO32—+H2O![]() HCO3-+OH—;
HCO3-+OH—;
②取少量氯化钙溶液滴入酚酞,不变红色,说明溶液不显碱性,证明:钙离子和氯离子不会引起溶液显碱性;
③取少量碳酸钠溶液,滴入酚酞后显红色,再加入氯化钙溶液的现象为产生白色沉淀,红色变浅并褪去,说明纯碱溶液呈碱性是由CO32-引起。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
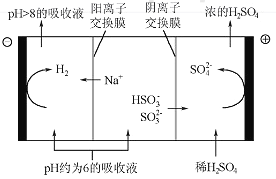
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
【题目】X、Y、Z、W为四种常见的短周期元素。其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答以下问题:
(1)W在周期表中位置___;
(2)X和氢能够构成+1价阳离子,其电子式是___,Y的气态氢化物比Z的气态氢化物的沸点高,缘故是___;
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的晶体类型为___,M的水溶液显酸性的缘故是___(用离子方程式表示)。
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是___。
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是___。




