题目内容
【题目】通过实验得出的结论正确的是![]()
A.将固体完全溶于水,滴加稀盐酸,出现白色沉淀,则该固体中存在![]()
B.将气体溶于水,再滴加硝酸银,出现白色沉淀,则该气体为HCl
C.向某无色溶液加NaOH溶液,加热,将湿润的蓝色石蕊试纸靠近试管口,若试纸变红,则说明原溶液中一定含![]()
D.向某无色溶液中滴加NaOH溶液,产生白色沉淀,则该溶液中可能存在![]()
【答案】D
【解析】
A.硅酸钠溶液中滴加稀盐酸也可以生成白色沉淀,则原溶液中不一定含有![]() ,故A错误;
,故A错误;
B. 该气体不一定为HCl,可能为氯气,故B错误;
C. 向某无色溶液加NaOH溶液,加热,应该将湿润的红色石蕊试纸靠近试管口,若试纸变蓝,则说明原溶液中一定含![]() ,故C错误;
,故C错误;
D. 若向碳酸氢钡溶液中滴加NaOH溶液,可以产生白色沉淀碳酸钡,故该溶液中可能存在![]() ,故D正确;
,故D正确;
故选:D。

 阅读快车系列答案
阅读快车系列答案【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
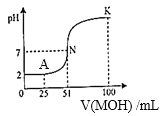
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
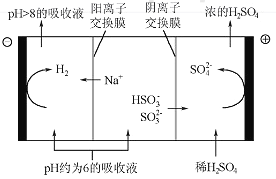
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
【题目】X、Y、Z、W为四种常见的短周期元素。其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答以下问题:
(1)W在周期表中位置___;
(2)X和氢能够构成+1价阳离子,其电子式是___,Y的气态氢化物比Z的气态氢化物的沸点高,缘故是___;
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的晶体类型为___,M的水溶液显酸性的缘故是___(用离子方程式表示)。
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是___。
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是___。