题目内容
4.NA代表阿伏加德罗常数,下列说法不正确的是( )| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
分析 A.D2O中含有10个电子,摩尔质量是20g/mol,据此进行计算;
B.丙烷分子中含有2个碳碳键和8个碳氢键,总共含有10个共价键;
C.NO2和N2O4最简式同为NO2,根据最简式计算92gNO2中所含原子数;
D.锌为2价金属,65g锌的物质的量为1mol,完全反应转移2mol电子.
解答 解:A.10g重水(D2O)的物质的量是0.5mol,D2O分子中含有10个电子,则0.5mol重水中含有的电子数为5NA,故A正确;
B.1molC3H8分子中含有2mol碳碳键、8mol碳氢键,总共含有10mol共价键,含有的共价键总数为10NA,故B正确;
C.92gNO2和N2O4的混合物中含有最简式NO2的物质的量为:$\frac{92g}{46g/mol}$=2mol,则混合物中含有的原子数=2×3×NA=6NA,故C错误;
D.65gZn的物质的量为1mol,1mol锌全部溶解在一定浓度的硝酸溶液中,最多失去2mol电子,则转移的电子数为2NA,故D正确;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列热化学方程式或离子方程式正确的是( )
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
15.设nA代表阿伏加德罗常数(nA)的数值,下列说法正确的是( )
| A. | 标准状况下,22.4 L HCl溶于水后溶液中含有nA个HCl分子 | |
| B. | 1L 0.1 mol•L-1的Na2SO4溶液中含有0.2 nA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为nA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nAFe3+ |
19.在恒容密闭容器中发生反应2SO2+O2?2SO3,当其他条件不变时,只改变一个条件,不能加快化学反应速率的是( )
| A. | 增加SO2的浓度 | B. | 充入一定量惰性气体 | ||
| C. | 升高温度 | D. | 使用催化剂 |
9.氨的合成是最重要的化工生产之一.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:
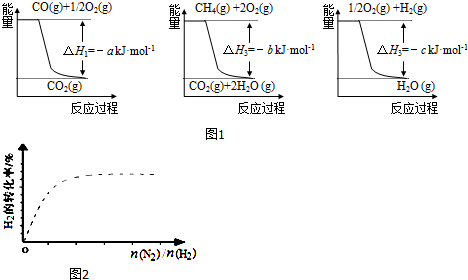
则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
①甲容器达到平衡所需要的时间t=5min(填“>”、“<”或“=”,下同);乙容器达到平衡时N2的浓度c=3mol•L-1.
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
(1)工业上可用甲烷与水反应得到合成氨用的H2:其热化学反应方程式为CH4(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+3H2(g)△H4,已知有关反应的能量变化如图1所示:

则△H4=(a+3c-b)kJ•mol-1(用a、b、c表示)
(2)在2个恒压的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)$?_{催化剂}^{高温高压}$2NH3(g),按不同方式投入反应物,保持恒温,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
②图2中虚线为该反应在使用催化剂条件下,关于起始N2与H2投料比和H2平衡转化率的关系图.当其他条件完全相同时,用实线画出不使用催化剂情况下H2平衡转化率的示意图.
16.烷烃C5H12的同分异构体数目是( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
13.在常温下,下列有关溶液中粒子的物质的量浓度的说法正确的是( )
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
14.NA为阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 常温下,2LpH=12的氨水中含有OH-数目为0.02NA | |
| B. | 氯碱工业中,外电路中转移电子数为0.3NA时产生气体体积(标准状况)为4.48L | |
| C. | 标准状况下,11.2LCH3Cl中非极性共价键数目等于2.0NA | |
| D. | 一定条件下,1molI2和0.2molH2混合充分反应,转移的电子数为0.4NA |
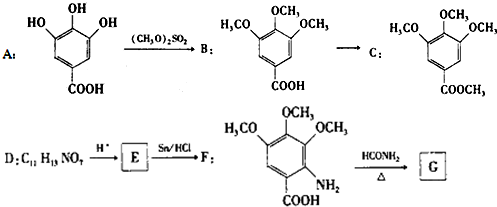
 .
.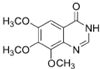 .
.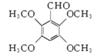 .
.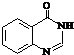 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.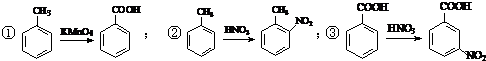 )
)