题目内容
【题目】下表为元素周期表前三周期的一部分:
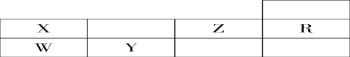
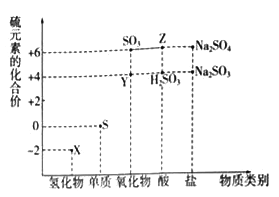
(1)判断X __________ Y __________ Z __________W__________R ________(写元素符号)。
(2)写出X的氢化物的化学式;__________,W的氢化物的化学式__________,其沸点比较:__________>________(填化学式)
(3)下图是X的基态原子的电子排布图,其中有一个是错误的,它不能作为基态原子的电子排布图是因为它不符合________。
①![]()
②![]()
(4)以上五种元素中,________(填元素符号)元素第一电离能最大。__________元素电负性最大,Y的基态原子的电子排布式为__________
【答案】N S F P Ne NH3 PH3 NH3 PH3 洪特规则 Ne F 1s22s22p63s23p4
【解析】
根据元素在元素周期表的位置可以分析,X为N元素,W为P元素,Y为S元素,R为Ne元素,Z为F元素,据此回答。
(1)根据分析,5种元素依次是N、S、F、P、Ne;
(2)X的氢化物的化学式为NH3,W的氢化物的化学式为PH3,因NH3中含有氢键,故NH3的沸点较高;
(3)图中①的基态原子电子排布图错误,因为它不符合洪特规则,洪特规则表明基态原子电子排布时应优先分占不同的轨道且自旋方向相同;
(4)以上五种元素中,Ne元素第一电离能最大,F元素电负性最大,Y的基态原子的电子排布式为1s22s22p63s23p4。

【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
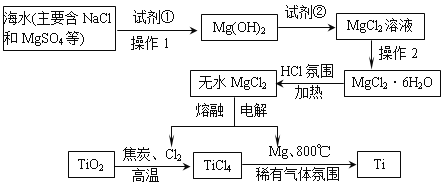
【题目】目前世界上60%的镁是从海水中提取的,从海水中提取的MgCl2制得Mg和Cl2,进一步联合用金红石(主要成分TiO2)冶炼金属钛,工业上其主要的生产流程如下:
|
回答下列问题:
(1)加入过量试剂①后,能够分离得到Mg(OH)2沉淀的方法操作1用到的玻璃仪器有________________________________________;试剂②可以选用______。
(2)要得到MgCl2·6H2O的操作2名称是___________________________________。
(3)工业上冶炼金属钛的上述生产流程,其第1步是在高温下向金红石(主要成分TiO2)与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃性气体,写出这步反应的化学方程式:____________________________。
(4) 工业上冶炼金属钛的上述生产流程,其第2步是在稀有气体氛围和加热的条件下,用镁与TiCl4反应得到钛,写出这步反应的化学方程式____________________,该反应时稀有气体氛围的作用是_____________________________________,该反应的金属冶炼方法属于是____________________。