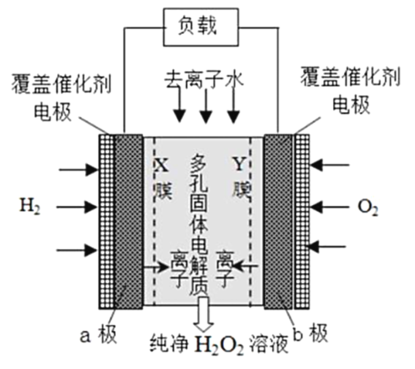
题目内容
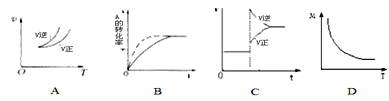
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
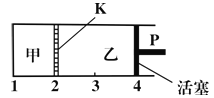
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
【答案】B
【解析】
A、根据该反应中反应物的状态以及各反应物的系数可以知道该反应是反应前后体积无变化的反应,根据甲乙两种投料的关系可以确定所得到的平衡时等效平衡,所以平衡后甲乙中B的体积分数相同,A错误;
B、活塞的位置变化后,乙中的压强减小,但是该反应是气体体积不变的反应,平衡不移动,故C的百分含量相同,B正确;
C、保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲=2c(B)乙,C错误;
D、保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙<c(B)甲,D错误;
故答案选B。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】下列“解释或结论”与“实验操作及现象”不相符的一组是
序号 | 实验操作及现象 | 解释或结论 |
A | 浓硫酸滴到纸张上,纸变黑 | 浓硫酸有脱水性 |
B | 向紫色石蕊溶液中加入氯水,溶液先变红,随后褪色 | 氯水中含有酸性物质和 漂白性物质 |
C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体 | 该溶液中一定有CO32- |
D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有NH |
A.AB.BC.CD.D