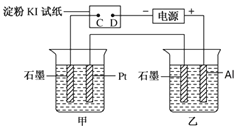
题目内容
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
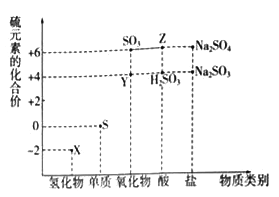
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______(填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______(填代号)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4则24mL 0.05molL﹣1的Na2SO3溶液与 20mL 0.02molL﹣1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为________。
【答案】SO2、H2SO3、Na2SO3 1:2 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑ b +3
CuSO4+2H2O+SO2↑ b +3
【解析】
S元素的化合价有-2价、0价、+4价、+6价。
(1)具有中间价态的元素既有还原性又有氧化性;
(2)将X为H2S与SO2混合,可生成淡黄色固体,是用二氧化硫的氧化性氧化硫化氢生成淡黄色沉淀S和水,元素化合价降低的物质做氧化剂,元素化合价降低的为还原剂;
(3)浓硫酸与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水;
(4)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须是一种大于2,另一种小于2;
(5)Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;K2Cr2O7中Cr元素发生还原反应,令Cr元素在产物中的化合价为+a价,根据电子转移守恒计算a的值。
S元素的化合价有-2价、0价、+4价、+6价。
(1)具有中间价态的元素既有还原性又有氧化性,S元素的化合价有-2价、0价、+4价、+6价,所以0价和+4价S的化合物既有还原性又有氧化性,即SO2,H2SO3、Na2SO3既有还原性又有氧化性;
(2)将X为H2S与SO2混合,可生成淡黄色固体,这是用SO2的氧化性来氧化H2S生成淡黄色沉淀S和水,反应的化学方程式为2H2S+SO2=3S↓+2H2O,反应中H2S中硫元素化合价-2价变化为0价,H2S做还原剂,SO2中硫元素+4价变化为0价,SO2做氧化剂,则该反应的氧化剂与还原剂的物质的量之比为1:2;
(3)浓硫酸与铜单质在加热条件下可以发生化学反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4) Na2S2O3中S元素化合价为+2价,从氧化还原的角度分析,反应物中S元素化合价必须一种物质中的大于2,另一种物质中的小于2,选项a中S化合价都小于2,选项c、d中S的化合价都大于2,所以只有选项b符合题意;
(5)假设Cr元素在生成物中的化合价为+a价,根据电子转移守恒,则24×10-3L×0.05mol/L ×(6-4)=20×10-3L×0.02mol/L×2×(6-a),解得a=+3。

【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4+6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察____________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成____________色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010 mol/L,则该样品中氮的质量分数为________。
【题目】对下列实验现象解释正确的是
实验内容 | 实验现象 | 相关解释 | |
A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2 |
A. A B. B C. C D. D