题目内容
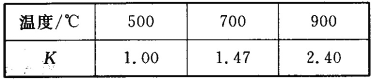
【题目】已知Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
FeO(s)+CO(g) △H=akJ/mol,平衡常数为K;测得在不同温度下,K值如下:
(1)若500℃时进行上述反应,CO2起始浓度为1 mol/L,CO的平衡浓度为_____。
(2)方程式中的a________0(填“大于”“小于”或“等于”)。
(3)900℃上述反应达到平衡,要使得该平衡向左移动,其他条件不变时,可以采取的措施有________(填序号)
A.缩小反应器体积 B.加入FeO
C.降低温度到500℃ D.使用合适的催化剂
【答案】0.5mol/L 大于 C
【解析】
(1)设500℃时,CO的平衡浓度为x
Fe(s)+CO2(g) ![]() FeO(s)+CO(g)
FeO(s)+CO(g)
起始量 1mol/L 0
变化量 x x
平衡量 (1-x)mol/L x
则K=![]() x=0.5mol/L
x=0.5mol/L
答案为:0.5mol/L
(2)从表中可以看出,升高温度,K值增大,说明平衡正向移动,正反应为吸热反应,
方程式中的a大于0。答案为:大于
(3) A.由于反应前后气体分子数相等,所以缩小反应器体积,平衡不发生移动,A不合题意;
B.由于FeO呈固态,所以加入FeO,对平衡不产生影响,B不合题意;
C.由于正反应为吸热反应,所以降低温度到500℃,平衡逆向移动,C符合题意;
D.使用合适的催化剂,对平衡不产生影响,D不合题意。
故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目