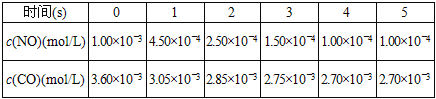
题目内容
【题目】下图是某学校实验室买回的硫酸试剂标签的部分内容。判断下列说法正确的是( )

A. 该硫酸的浓度为9.2 mol·L-1
B. 配制480 mL 4.6 mol·L-1的稀硫酸需该H2SO4125mL
C. 该硫酸与等体积水混合质量分数变为49%
D. 取该硫酸100 mL,则浓度变为原来的![]()
【答案】B
【解析】试题分析:A.浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L,故A错误;B.实验室没有480mL容量瓶,应选择500mL容量瓶,溶液稀释前后溶质物质的量不变,则需要浓硫酸的体积=
mol/L=18.4mol/L,故A错误;B.实验室没有480mL容量瓶,应选择500mL容量瓶,溶液稀释前后溶质物质的量不变,则需要浓硫酸的体积=![]() =125.0mL,故应量筒量取该硫酸125.0mL,故B正确;C.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,根据质量分数=
=125.0mL,故应量筒量取该硫酸125.0mL,故B正确;C.水的密度小于硫酸的密度,等体积混合所得溶液质量小于原硫酸溶液的2倍,稀释后溶质硫酸不变,根据质量分数=![]() ×100%,可知混合后溶液质量分数大于49%,故C错误;D.溶液具有均一性浓度不变,故D错误;故选B。
×100%,可知混合后溶液质量分数大于49%,故C错误;D.溶液具有均一性浓度不变,故D错误;故选B。

 快乐5加2金卷系列答案
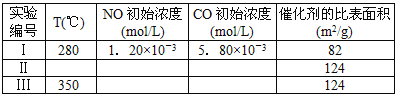
快乐5加2金卷系列答案【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:__________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为____________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
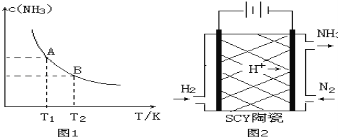
当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”)。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
若N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)