题目内容
【题目】“臭碱![]() ”广泛应用于冶金染料、皮革、电镀等工业,可利用反应
”广泛应用于冶金染料、皮革、电镀等工业,可利用反应![]() 制备。已知
制备。已知![]() ,
,![]() 。下列说法正确的是( )
。下列说法正确的是( )
A.反应中生成1 mol“臭碱”时转移电子数为![]()
B.该反应的氧化产物与还原产物的物质的量比为![]()
C.![]() 溶液中含有的阴离子数目大于
溶液中含有的阴离子数目大于![]()
D.将![]() 溶液露置于空气中不会有
溶液露置于空气中不会有![]() 气体放出
气体放出
【答案】C
【解析】
A.根据反应方程式,生成1 mol“臭碱”时,S的化合价由+6价变为-2价,共转移8mol电子,即转移的电子数为8NA,A选项错误;
B.该反应的氧化产物为CO2,还原产物为Na2S,有方程式可知,其物质的量之比为2:1,B选项错误;
C.1L 0.1mol·L-1Na2S溶液中S2-发生水解:S2-+H2O![]() HS-+OH-,阴离子总数大于0.1NA,C选项正确;
HS-+OH-,阴离子总数大于0.1NA,C选项正确;
D.因为Ka1(H2S)<Ka1(H2CO3),则H2S的酸性比碳酸弱,将Na2S溶液露置于空气中,会发生反应:CO2+Na2S+H2O===Na2CO3+H2S,有H2S气体放出,D选项错误;
答案选C。

【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
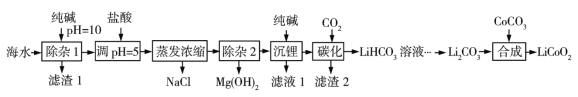
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
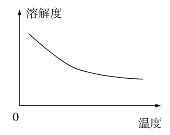
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
【题目】下列实验方案的设计能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 验证 | 向 |
B | 比较HF与 | 常温下,用pH试纸分别测定浓度均为 |
C | 验证 | 向 |
D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
A.AB.BC.CD.D