题目内容
7.下列说法正确的是( )| A. | 大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | Na2O2、NH4C1、MgCl2均属于含有共价键的离子化合物 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 玻璃、水泥和光导纤维的主要成分都是硅酸盐 |
分析 A.蛋白质要在催化剂作用下才能水解为氨基酸;
B.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,离子化合物一定含有离子键,可能含有共价键,共价化合物只含共价键一定不含离子键;
C.乙烯发生加聚反应生成聚乙烯;氯乙烯发生加聚反应生成聚氯乙烯;
D.光导纤维的成分为二氧化硅.
解答 解:A.豆浆煮沸是蛋白质发生了变性,故A错误;
B.MgCl2中镁离子和氯离子之间只存在离子键,故B错误;
C.乙烯发生加聚反应生成聚乙烯;氯乙烯发生加聚反应生成聚氯乙烯,聚乙烯和聚氯乙烯都是高分子化合物,故C正确;
D.光导纤维的成分为二氧化硅,不是硅酸盐,故D错误.
故选C.
点评 本题考查蛋白质的性质、化学键、高分子化合物以及硅酸盐,难度较小,旨在考查学生对基础知识的识记,注意基础知识的积累掌握.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
18.下列各种离子一定能大量共存的是( )
| A. | 强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| B. | 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | c(OH-)=1×10-13 mol/L的溶液中:K+、Fe2+、Cl-、NO3- |
2. 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
12.下列叙述或解释事实的方程式错误的是( )
| A. | pH=1的NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| C. | 用NaHCO3溶液做导电实验,灯泡发光:NaHCO3=Na++H++CO32- | |
| D. | 盛满NO2的烧瓶浸泡在冷水中,颜色变浅:NO2 (g,红棕色)?N2O4(g,无色)△H<0 |
16.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO制备HClO |
| A. | A | B. | B | C. | C | D. | D |
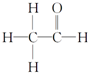 ,其PMR谱中有2个信号峰,其强度之比为3:1.
,其PMR谱中有2个信号峰,其强度之比为3:1.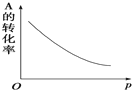 密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示:
密闭容器中mA(g)+nB(g)?pC(g),反应达到平衡状态,经测定增大压强p时,A的转化率随p而变化的曲线如图所示: