题目内容
10. 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是学习研究其它化学知识的载体.(1)从以上元素中选择,在自然界中有游离态存在的除铁、硫外还有N元素(填元素符号).
(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到右边的现象为溶液由浅绿色变红色,左边发生反应的离子方程式:2H++2Fe2++H2O2=2H2O+2Fe3+;;
若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2molNH4Al(SO4)2的溶液,右边充满含3molBa(OH)2的溶液,当有2molSO42-通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为2:3.
(3)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O.
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH.
分析 (1)N、S、Fe在自然界中有游离态存在,Na、Mg、Al、Cl、Si在自然界中全部以化合态存在;
(2)亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;当有2mol SO42-通过交换膜时,根据电荷守恒则有4molOH-进入左室,左室生成氢氧化铝$\frac{4}{3}$mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3;
(3)根据题意,石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃;
①a应该是SiCl4,结合a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性(Na2SiO3);
②b是AlCl3、FeCl3、MgCl2的混合物,与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;向滤液中继续加适量乙酸乙酯并加热可得沉淀氢氧化铝.
解答 解:(1)Na、Mg、Al、Cl、Si在自然界中全部以化合态存在,N、S、Fe在自然界中有游离态存在,故答案为:N;
(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),当有2mol SO42-通过交换膜时,根据电荷守恒则有4molOH-进入左室,左室生成氢氧化铝$\frac{4}{3}$mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3;
故答案为:溶液由浅绿色变红色;2H++2Fe2++H2O2=2H2O+2Fe3+;2:3;
(3)根据题意,石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃;
①a应该是SiCl4,结合a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性(Na2SiO3)得:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
故答案为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
②b是AlCl3、FeCl3、MgCl2的混合物,与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;向滤液中继续加适量乙酸乙酯并加热可得沉淀氢氧化铝,生成沉淀的离子方程式为:CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH;
故答案为:Cl-、OH-、AlO2-,CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH.
点评 本题考查了铝、铁、镁及化合物的性质,理解离子交换膜的作用是关键,掌握题干信息和物质性质是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 婴儿用的“尿不湿”可吸入其自身重量的几百倍的尿液而不滴不漏,是因为在制作过程中加入了无机物吸水剂的缘故 | |
| B. | 人造纤维可利用竹子、棉花、麻类的纤维材料制成,而合成纤维是利用自然界的非纤维材料(如石油、煤)通过化学合成方法得到 | |
| C. | 盐碱地(含较多NaCl、Na2CO3)可通过施加适量石膏降低土壤的碱性 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
| A. | A2BC3 | B. | A4BC4 | C. | ABC4 | D. | A4B2C2 |
| A. | SiC中硅元素的化合价为-4价,SiC属于共价化合物 | |
| B. | 标准状况下,22.4LCCl4中所含共价键数目为4NA | |
| C. | 该反应中CCl4是还原剂 | |
| D. | 每转移8mol电子,会生成1molSiC |
| A. | 硅是构成一些岩石和矿物的基本元素,单质硅是良好的半导体材料 | |
| B. | 水泥、玻璃、水晶饰物都硅酸盐制品 | |
| C. | 玻璃是氧化物,成分可表示为Na2O•CaO•6SiO2 | |
| D. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料 |
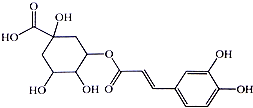 银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )
银翘的金银花与连翘配成的中成药,具有辛凉解表,清热解毒,用于流行感冒引起的发热、咳嗽、口干、咽喉肿痛.其中的一种具有较广泛的杀菌作用的有效成分--绿原酸,结构简式见图.下列描述错误的是( )| A. | 绿原酸有可能通过酯化反应人工合成 | |
| B. | 1mol绿原酸能与4molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生反应放出CO2 |
| A. | C2=2C1 | B. | C2>2C1 | C. | C2<2C1 | D. | C1=2C2 |
| A. | 0.01 mol/L的H2A溶液 | |
| B. | 0.01 mol/L的NaHA溶液 | |
| C. | 0.02 mo|/L的NaOH溶液与0.02 mol/L的NaHA溶液等体积混合 | |
| D. | 0.02 mol/L的HCl溶液与0.04 mol/L的NaHA溶液等体积混合 |