题目内容
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气2bg,且向反应后的溶液中加人KSCN溶液,不显红色,则原混合物中氧化铁的物质的量为
A.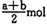 B (a — b) mol
B (a — b) mol
C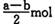 D. (a+b) mol
D. (a+b) mol
A.
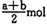 B (a — b) mol
B (a — b) molC
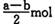 D. (a+b) mol
D. (a+b) molC
本题铁及化合物的计算。根据题意知:Fe和Fe2O3的混合物与盐酸反应再加入KSCN不显红色,这说明无Fe3+,且放出H2 bmol。所发生的反应方程式为: Fe2O3+6HCl 2FeCl3+3H2O①Fe+2HCl
2FeCl3+3H2O①Fe+2HCl FeCl2+H2↑②2Fe3++Fe
FeCl2+H2↑②2Fe3++Fe 3Fe2+③
3Fe2+③
由②可知,放出H2 bmol就是有bmolFe与酸反应,则多余的Fe和Fe2O3的物质的量为(a-b) mol,再根据①与③写出总方程式为
Fe2O3 + Fe + 6HCl 3FeCl2+3H2O
3FeCl2+3H2O
1 mol 1 mol
则Fe2O3的物质的量为(a-b)/2 mol。故选C
 2FeCl3+3H2O①Fe+2HCl
2FeCl3+3H2O①Fe+2HCl FeCl2+H2↑②2Fe3++Fe
FeCl2+H2↑②2Fe3++Fe 3Fe2+③
3Fe2+③由②可知,放出H2 bmol就是有bmolFe与酸反应,则多余的Fe和Fe2O3的物质的量为(a-b) mol,再根据①与③写出总方程式为
Fe2O3 + Fe + 6HCl
 3FeCl2+3H2O
3FeCl2+3H2O1 mol 1 mol
则Fe2O3的物质的量为(a-b)/2 mol。故选C

练习册系列答案
相关题目
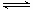 Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。
Fe(s) + CO2(g)的平衡常数K=1/3,则反应达平衡时FeO的转化率为 。 况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为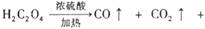
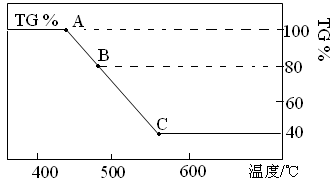
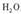 。下列装置中,可用作上述反应制取气体的是(填编号)。
。下列装置中,可用作上述反应制取气体的是(填编号)。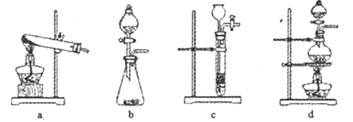
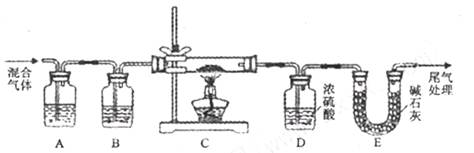
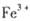 外还可能含有
外还可能含有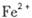 。若要确认其中的
。若要确认其中的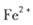 .应选用 ________________(填编号)。
.应选用 ________________(填编号)。