题目内容
把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉质量相等,则原溶液中H+和SO42-的物质的量之比为
| A.1∶4 | B.2∶7 |
| C.1∶2 | D.8∶31 |
A
投入铁粉后发生的反应为Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu,由于残余固体的质量与原来加入的铁粉质量相等,因此置换出的铜和参加反应的铁的质量是相同的。若设置换出了xmol铜,则和铜离子反应的铁是xmol,则与氢离子反应的铁是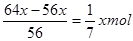 。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是
。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是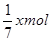 和xmol,所以原溶液中H+和SO42-的物质的量之比为
和xmol,所以原溶液中H+和SO42-的物质的量之比为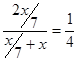 。所以答案是A。
。所以答案是A。
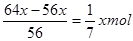 。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是
。根据原子守恒可知硫酸和硫酸铜的物质的量分别就是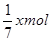 和xmol,所以原溶液中H+和SO42-的物质的量之比为
和xmol,所以原溶液中H+和SO42-的物质的量之比为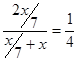 。所以答案是A。
。所以答案是A。
练习册系列答案
相关题目
 )。
)。
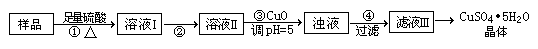
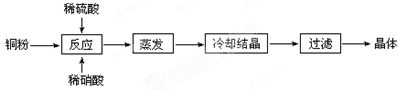
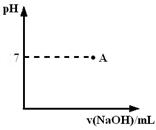

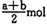 B (a — b) mol
B (a — b) mol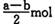 D. (a+b) mol
D. (a+b) mol