题目内容
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。则原混合物中氧化铁的质量是
| A.2.4g | B.3.36g | C.5.60g | D.6.4g |
D
方法一:由题知反应后的溶液显酸性,则1.28 g固体全是铜,无铁,溶液中不含Fe3+,即溶液中只有Fe2+和H+, 总共发生了以下反应:Fe+2HCl=FeCl2+H2↑ CuO+2HCl=CuCl2+H2O
2mol 22400mL 2 1
n1 896mL 2n5 n5
Fe2O3+6HCl=2FeCl3+3H2O Fe+CuCl2=FeCl2+Cu Fe+2FeCl3=3FeCl2
1mol 6mol 2mol 1mol1mol 1mol 64g
n2 n3 n4 n5=0.02mol 1.28g
n1+2n5 +n3 =0.1L× 4.40mol/L-0.2L×0.4mol/L=0.36mol,n1=0.08mol,n5=0.02mol,则n3=0.24mol,n2=0.04mol即氧化铁的质量是6.4g。
方法二:根据题意,溶液的成分为FeCl2、HCl,设Fe、Fe2O3的物质的量分别为x、y,根据得失电子守恒和物料守恒得2x=2y+×2+×2="2y+0.04+0.08," x+2y=(0.1L×4.40mol/L-0.2L×0.4mol/L)/2=0.18mol,y=0.04mol,即氧化铁的质量是6.4g。
2mol 22400mL 2 1
n1 896mL 2n5 n5
Fe2O3+6HCl=2FeCl3+3H2O Fe+CuCl2=FeCl2+Cu Fe+2FeCl3=3FeCl2
1mol 6mol 2mol 1mol1mol 1mol 64g
n2 n3 n4 n5=0.02mol 1.28g
n1+2n5 +n3 =0.1L× 4.40mol/L-0.2L×0.4mol/L=0.36mol,n1=0.08mol,n5=0.02mol,则n3=0.24mol,n2=0.04mol即氧化铁的质量是6.4g。
方法二:根据题意,溶液的成分为FeCl2、HCl,设Fe、Fe2O3的物质的量分别为x、y,根据得失电子守恒和物料守恒得2x=2y+×2+×2="2y+0.04+0.08," x+2y=(0.1L×4.40mol/L-0.2L×0.4mol/L)/2=0.18mol,y=0.04mol,即氧化铁的质量是6.4g。

练习册系列答案
相关题目
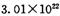 个 B原混合物:
个 B原混合物: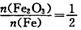
 D .所得溶液:
D .所得溶液:
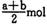 B (a — b) mol
B (a — b) mol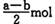 D. (a+b) mol
D. (a+b) mol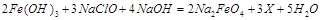 ,则X的化学式为 。
,则X的化学式为 。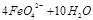

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。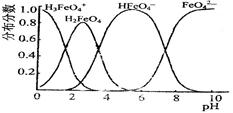

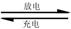
 则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。
则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。