题目内容
(7分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应式: ,负极反应式: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
| |
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓硫酸 NaOH溶液 CuO Cu | ||
(7分,每空1分,装置图1分,第(3)小问3分) (1)2Fe3++Cu===2Fe2++Cu2+
(2)装置图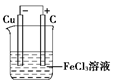 2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(2)装置图
 2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+
2Fe3++2e-===2Fe2+ Cu-2e-===Cu2+(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(1)氯化铁能溶解单质铜,反应的方程式是2Fe3++Cu===2Fe2++Cu2+。
(2)由于原电池中负极失去电子,正极得到电子,因此根据反应式可知,负极是铜,正极可以是石墨等,而电解质溶液应该是氯化铁,装置图为(见答案)。其中电极反应式是正极:2Fe3++2e-===2Fe2+、负极:Cu-2e-===Cu2+。
(3)根据表中数据可知,沉淀亚铁离子的pH大于沉淀铜离子的pH,所以应该将溶液中的亚铁离子氧化生成铁离子,然后在调节pH将铁离子沉淀出来。即正确的做法是①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2~4.7;③过滤[除去Fe(OH)3]。
(2)由于原电池中负极失去电子,正极得到电子,因此根据反应式可知,负极是铜,正极可以是石墨等,而电解质溶液应该是氯化铁,装置图为(见答案)。其中电极反应式是正极:2Fe3++2e-===2Fe2+、负极:Cu-2e-===Cu2+。
(3)根据表中数据可知,沉淀亚铁离子的pH大于沉淀铜离子的pH,所以应该将溶液中的亚铁离子氧化生成铁离子,然后在调节pH将铁离子沉淀出来。即正确的做法是①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液pH至3.2~4.7;③过滤[除去Fe(OH)3]。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
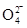 )。
)。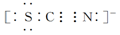
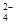 的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
的某溶液中(只来源于水电离的离子不考虑)加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )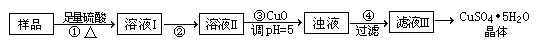
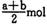 B (a — b) mol
B (a — b) mol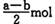 D. (a+b) mol
D. (a+b) mol