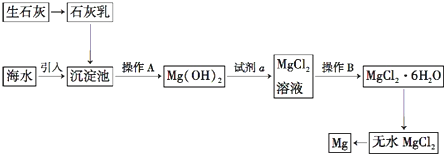
题目内容
1.下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体.| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的电子式
 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.(3)c与氢形成的分子X的空间构型为V型;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S2-+H2O.
(4)上述元素所能形成的简单离子中半径最小的是Mg2+(填离子符号),最高价氧化物对应水化物酸性最强的是HBrO4(填分子式),e元素与N元素形成化合物的电子式为
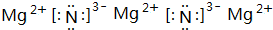 .
.(5)b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是4个Na+、4个Cl-.
分析 Na、Mg、Si、S、Br五种元素中,b、e均是热和电的良导体,则为Na、Mg,沸点b<e,则b为Na、e为Mg;由其它元素单质沸点,可知d为Si、a为Br、c为s.
(1)a为溴,处于第四周期第ⅦA族;
(2)d为Si镁原子核外有4个电子,其最高价氧化物为二氧化硅,属于原子晶体,硅与氢氧化钠反应生成硅酸钠与氢气;
(3)c与氢形成的分子X为H2S,与是分子的空间构型相同,b元素的最高价氧化物对应水化物为NaOH,硫氢化与足量的NaOH反应生成硫化钠与水;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多,离子半径越大;非金属性越强,最高价氧化物对应水化物酸性越强;e元素与N元素形成化合物为Mg3N2,属于离子化合物;
(5)b元素与氯元素形成的化合物Y为NaCl,晶胞结构图为 ,可以均摊法计算晶胞中Na+、Cl-数目.
,可以均摊法计算晶胞中Na+、Cl-数目.
解答 解:Na、Mg、Si、S、Br五种元素中,b、e均是热和电的良导体,则为Na、Mg,沸点b<e,则b为Na、e为Mg;由其它元素单质沸点,可知d为Si、a为Br、c为s.
(1)a为溴,处于第四周期第ⅦA族,故答案为:第四周期第ⅦA族;
(2)d为Si镁原子核外有4个电子,电子式为 ,其最高价氧化物为二氧化硅,属于原子晶体,硅与氢氧化钠溶液反应生成硅酸钠与水,反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
,其最高价氧化物为二氧化硅,属于原子晶体,硅与氢氧化钠溶液反应生成硅酸钠与水,反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为: ;原子; Si+2OH-+H2O=SiO32-+2H2↑;
;原子; Si+2OH-+H2O=SiO32-+2H2↑;
(3)c与氢形成的分子X为H2S,与是分子的空间构型相同,为V型结构,b元素的最高价氧化物对应水化物为NaOH,硫氢化与足量的NaOH反应生成硫化钠与水,反应离子方程式为:H2S+2OH-=S2-+H2O,
故答案为:V型;H2S+2OH-=S2-+H2O;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多,离子半径越大,故离子半径:Br->S2->Na+>Mg2+;
非金属性:Br>S>Si,非金属性越强,最高价氧化物对应水化物酸性越强,故HBrO4酸性最强;
e元素与N元素形成化合物为Mg3N2,属于离子化合物,电子式为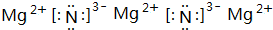 ,
,
故答案为:Mg2+;HBrO4;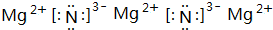 ;
;
(5)b元素与氯元素形成的化合物Y为NaCl,由钠离子与氯离子过程,其晶胞结构图为 ,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4,Cl-数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,
,晶胞中Na+离子数目为1+12×$\frac{1}{4}$=4,Cl-数目为6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,
故答案为:4个Na+、4个Cl-.
点评 本题考查晶体类型与性质、电子式、空间构型、离子半径比较、元素周期律应用、离子方程式书写、晶胞计算等,是对学生综合能力的考查,难度中等.

| A. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| B. | 乙酸和油脂都能与氢氧化钠溶液反应 | |
| C. | 2-戊烯存在顺反异构现象 | |
| D. | 乙烯和苯都能与酸性高锰酸钾溶液、溴水反应 |
| A. | $\frac{1-W}{7}$ | B. | $\frac{3W}{4}$ | C. | $\frac{6(1-W)}{7}$ | D. | $\frac{12(1-W)}{13}$ |
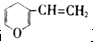 互为同分异构体,其中遇氯化铁溶液显紫色和不显紫色的芳香族化合物分别有( )
互为同分异构体,其中遇氯化铁溶液显紫色和不显紫色的芳香族化合物分别有( )| A. | 3种和2种 | B. | 2种和2种 | C. | 2种和1种 | D. | 3种和1种 |
| A. | C2H2 | B. | C3H6 | C. | C7H8 | D. | C2H4 |
| A. | 逆反应停止 | B. | 正逆反应速率相等 | ||
| C. | 反应停止产生热 | D. | 反应物与产物浓度相等 |
| A. | 甲苯和苯酚 | B. | 乙醇和乙醛 | C. | 硝基苯和水 | D. | 乙酸和乙酸乙酯 |