题目内容
9.甲醛、C3H6O和乙酸组成的混合物中,氧元素的质量分数是W,则碳元素的质量分数为( )| A. | $\frac{1-W}{7}$ | B. | $\frac{3W}{4}$ | C. | $\frac{6(1-W)}{7}$ | D. | $\frac{12(1-W)}{13}$ |
分析 根据混合物中氧元素的质量分数计算出碳元素与氢元素的总的质量分数,甲醛(HCHO)、C3H6O、乙酸(CH3COOH)中碳原子与氢原子个数之比为1:2,则混合物中碳元素与氢元素的质量之比为6:1,据此计算.
解答 解:在混合物中,只有C、H、O三种元素,氧元素的质量分数为37%,则碳元素和氢元素的总的质量分数为(1-W),在甲醛(HCHO)、C3H6O、乙酸(CH3COOH)组成的混合物中,碳原子与氢原子个数之比为1:2,则碳元素与氢元素的质量之比为12:2=6:1,所以碳元素的质量分数为$\frac{6}{7}$(1-W),故选C.
点评 本题考查混合物中元素的质量分数的计算,关键是利用混合物中各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
2.下列实验方案的设计中,不正确的是( )
| A. | 用灼烧法鉴别羊毛纤维和棉纤维 | |
| B. | 用适量稀硫酸清除铁制品表面的铁锈 | |
| C. | 用适量熟石灰除去氯化钠溶液中少量的碳酸钠 | |
| D. | 用足量稀盐酸检验久置的氢氧化钠固体是否变质 |
20.把Ca(OH)2溶入蒸馏水中,一定时间后达到以下平衡:Ca(OH)2(s)?Ca2++2OH-,加入以下溶液,可使Ca(OH)2(s)减少的是( )
| A. | CaO | B. | AlCl3 | C. | NaOH | D. | CaCl2 |
17.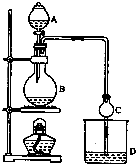 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
请回答:
(1)浓硫酸的作用是酸性、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H218O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)采用分液(操作名称)法从 D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出乙醇;再加入(从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是酸性、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H218O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)采用分液(操作名称)法从 D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出乙醇;再加入(从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
4.对于下列常见化学的认识错误的是( )
| A. | 明矾可用作净水剂 | |
| B. | 干冰能用于人工降雨 | |
| C. | 小苏打是一种膨松剂,可用于制作馒头和面包 | |
| D. | 碳酸钙是文物陶瓷的主要成分 |
14.分别处于元素周期表第2、3周期的主族元素A和B,它们离子的核外电子层相差两层.已知A处于第m族,B处于第n族,且A只有正化合价.则A、B两元素的原子序数分别为( )
| A. | m、n | B. | m-2、10-n | C. | m+2、n+10 | D. | m+8、n+10 |
1.下表是Na、Mg、Si、S、Br五种元素的单质的沸点,其中b、e均是热和电的良导体.
(1)a的元素在元素周期表中的位置为第四周期第ⅦA族.
(2)写出d的元素原子的电子式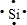 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
(3)c与氢形成的分子X的空间构型为V型;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S2-+H2O.
(4)上述元素所能形成的简单离子中半径最小的是Mg2+(填离子符号),最高价氧化物对应水化物酸性最强的是HBrO4(填分子式),e元素与N元素形成化合物的电子式为 .
.
(5)b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是4个Na+、4个Cl-.
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的电子式
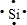 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.(3)c与氢形成的分子X的空间构型为V型;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S2-+H2O.
(4)上述元素所能形成的简单离子中半径最小的是Mg2+(填离子符号),最高价氧化物对应水化物酸性最强的是HBrO4(填分子式),e元素与N元素形成化合物的电子式为
 .
.(5)b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是4个Na+、4个Cl-.
18.下列微粒中,既含有离子键又含有共价键的是( )
| A. | NH3 | B. | NH4Cl | C. | H2S | D. | KCl |
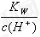 =0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3-