题目内容
12.目前,世界上60%的镁是从海水提取的.海水提镁的主要流程如下: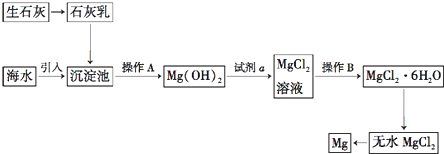
回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀),写出在沉淀池中反应的离子方程式Mg2++2OH-═Mg(OH)2↓.
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的贝壳.
(3)操作A是过滤,加入的足量试剂a是HCl(填化学式).
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
分析 根据题中工业流程可知,生石灰氧化钙溶于水生成氢氧化钙,加入海水中沉淀镁离子生成氢氧化镁沉淀,过滤后加入盐酸溶解得到氯化镁溶液,蒸发浓缩冷却结晶得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到氯化镁固体,熔融电解得到金属镁;
(1)石灰乳的溶解性大于氢氧化镁,所以石灰乳和镁离子反应生成Mg(OH)2沉淀;
(2)贝壳的主要成分是CaCO3,从充分利用海洋化学资源,提高经济效益的角度,应该用贝壳制取生石灰;
(3)分离难溶性固体和溶液采用过滤的方法分离,根据反应流程图前后推断试剂a的成份;
(4)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,据此书写电解方程式;
解答 解:(1)石灰乳的溶解性大于氢氧化镁,所以石灰乳和镁离子反应生成Mg(OH)2沉淀,则石灰乳的作用是沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀),在沉淀池中反应的离子方程式为Mg2++2OH-═Mg(OH)2↓,
故答案为:沉淀Mg2+(或使Mg2+形成Mg(OH)2沉淀);Mg2++2OH-═Mg(OH)2↓;
(2)贝壳的主要成分是CaCO3,从充分利用海洋化学资源,提高经济效益的角度,应该用贝壳制取生石灰,
故答案为:贝壳;
(3)分离不溶于水的固体和液体,可用过滤的方法,从沉淀池中得到氢氧化镁用过滤的方法,从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,加入的足量试剂a是HCl,
故答案为:过滤;HCl;
(4)无水MgCl2在熔融状态下,通电后会生成Mg和Cl2,电解方程式为MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑,氯气和氢气反应生成HCl而制备稀盐酸,从而达到循环利用的目的,
故答案为:MgCl2(熔融) $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑;
点评 本题考查海水资源的综合利用,明确海水中的成分及物质的性质是解本题关键,会分析流程图中各步发生的反应及操作方法,能从经济效益方面考虑,同时考查学生学以致用能力.

| A. | 工业上利用热还原法冶炼金属Fe、Cr、Mn | |
| B. | Fe位于元素周期表的第四周期、第ⅧB族 | |
| C. | ${\;}_{22}^{46}$TiO2、${\;}_{22}^{48}$TiO2、${\;}_{22}^{50}$TiO2互为同位素 | |
| D. | ${\;}_{41}^{92}$Nb3+原子核内有51个中子,核外有44个电子 |
| A. | CaO | B. | AlCl3 | C. | NaOH | D. | CaCl2 |
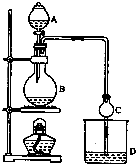 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)浓硫酸的作用是酸性、催化剂、脱水剂;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H218O.
(2)球形干燥管C的作用是防止倒吸、冷凝.若反应前向D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)采用分液(操作名称)法从 D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,然后加入无水氯化钙,分离出乙醇;再加入(从下列选项中选择)C,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰.
| A. | 明矾可用作净水剂 | |
| B. | 干冰能用于人工降雨 | |
| C. | 小苏打是一种膨松剂,可用于制作馒头和面包 | |
| D. | 碳酸钙是文物陶瓷的主要成分 |
| 单质 | a | b | c | d | e |
| 沸点(℃) | 58.8 | 882.9 | 444.7 | 2 355 | 1 107 |
(2)写出d的元素原子的电子式
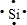 ;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.
;其最高价氧化物形成的晶体为原子晶体(填类型),d单质溶于强碱的离子方程式为Si+2OH-+H2O=SiO32-+2H2↑.(3)c与氢形成的分子X的空间构型为V型;写出X的水溶液与足量b元素的最高价氧化物对应水化物反应的离子方程式H2S+2OH-=S2-+H2O.
(4)上述元素所能形成的简单离子中半径最小的是Mg2+(填离子符号),最高价氧化物对应水化物酸性最强的是HBrO4(填分子式),e元素与N元素形成化合物的电子式为
 .
.(5)b元素与氯元素形成的化合物Y的晶体中,1个晶胞内含有的基本微粒及个数是4个Na+、4个Cl-.
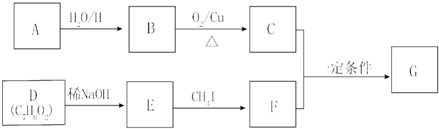
 +RCH2I→
+RCH2I→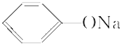
 .
.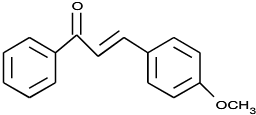 (不要求立体异构).
(不要求立体异构).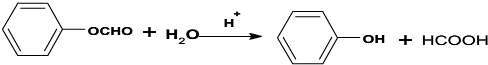 .
.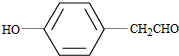 .(写结构简式)
.(写结构简式) B
B