题目内容
11.(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应,已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,
则2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=1 530 kJ•mol-1;
(2)饮用水中的 NO3-主要来自于NH4+.已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-.两步反应的能量变化示意图如图:
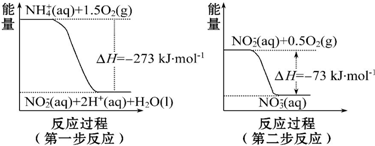
1mol NH4+全部被氧化成NO3-的热化学方程式为NH4+ (aq)+2O2(g)═NO3- (aq)+2H+(aq)+H2O(l)△H=-346 kJ•mol-1.
分析 (1)已知①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1;
以上两热化学方程式消去氢气合并,①×2+②×3得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol;
(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol.
解答 解:(1)已知①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1;
以上两热化学方程式消去氢气合并,①×2+②×3得到热化学方程式为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530kJ/mol,
故答案为:+l530kJ/mol;
(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol,
故答案为:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol.
点评 本题盖斯定律的应用,题目难度不大,注意热化学方程式的处理.

练习册系列答案
相关题目
19.已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
| A. | 据反应①可知N2的燃烧热为180 kJ•mol-1 | |
| B. | 2H2O(l)═2H2(g)+O2(g)△H>+483.6 kJ•mol-1 | |
| C. | 反应②在恒温恒容密闭容器反应达平衡后,充入N2,平衡正向移动,氮气的转化率减小,该反应的平衡常数增加 | |
| D. | 可推知,氨的催化氧化的热化学方程式为4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=-906 kJ•mol-1 |
16.类推的思维方法在化学学习与研究中常会产生错误的结论.因此类推出的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中正确的是( )
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 | |
| B. | NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色 | |
| D. | CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
20.下列各组物质,两种物质的最简式都为CH2O,且都能发生银镜反应的是( )
| A. | 甲醛和乙醛 | B. | 丙烯醛和苯甲醛 | C. | 乙酸和甲酸甲酯 | D. | 甲醛和葡萄糖 |
9.下列过程中化学键没有被破坏的是( )
| A. | 水沸腾汽化 | |
| B. | 水加热到1500℃开始分解 | |
| C. | 熔融的氯化钠 | |
| D. | 煤矿中瓦斯(主要成分是甲烷)遇火爆炸 |
 ,属于离子化合物.
,属于离子化合物. .
.