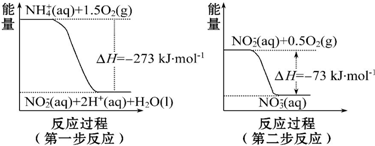
题目内容
2.第三周期元素A、B、C,其原子序数依次增大,已知A的焰色为黄色,C的某种氧化物是形成酸雨的主要原因,且这三种元素的最高价氧化物对应水化物中,有一种具有两性,且它们两两之间都能反应生成盐和水.(1)写出元素名称ANa BAl CS
(2)C 2-离子结构示意图为
(3)A和C形成的化合物电子式为
 ,属于离子化合物.
,属于离子化合物.(4)用电子式表示A和C形成化合物的过程:
 .
.
分析 第三周期元素A、B、C,其原子序数依次增大,A的焰色为黄色,则A为Na;C的某种氧化物是形成酸雨的主要原因,则C为S,且这三种元素的最高价氧化物的水化物有一种具有两性,且他们两两之间都能反应生成盐和水,则B为Al,据此解答.
解答 解:第三周期元素A、B、C,其原子序数依次增大,A的焰色为黄色,则A为Na;C的某种氧化物是形成酸雨的主要原因,则C为S,且这三种元素的最高价氧化物的水化物有一种具有两性,且他们两两之间都能反应生成盐和水,则B为Al,
(1)由上述分析可知,A为Na,B为Al,C为S,故答案为:Na;Al;S;
(2)S2-离子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)A和C形成的化合物为Na2S,由钠离子与硫离子构成,电子式为 ,属于离子化合物,故答案为:
,属于离子化合物,故答案为: ;离子;
;离子;
(4)用电子式表示Na和S形成化合物的过程为 ,
,
故答案为: .
.
点评 本题考查元素化合物推断,比较基础,侧重对化学用语的考查,注意对基础知识的掌握.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
12. 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
但Ni粉中的杂质不与CO(g)发生反应.玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是( )
 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)但Ni粉中的杂质不与CO(g)发生反应.玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是( )
| A. | 在石英管右端主要物质是Ni(CO)4(g) | |
| B. | 在石英管右端主要物质是纯Ni(s)和CO(g) | |
| C. | 在石英管左端主要物质是纯Ni(s)和CO(g) | |
| D. | 整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |
14.SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于石蕊溶液,可观察到石蕊溶液( )
| A. | 由紫色变为无色 | B. | 颜色无明显变化 | C. | 先褪色,后复原 | D. | 由紫色变为红色 |
 如图所示水槽中试管内有一枚铁钉,放置数天观察:
如图所示水槽中试管内有一枚铁钉,放置数天观察: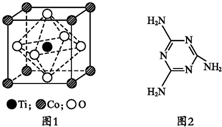 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.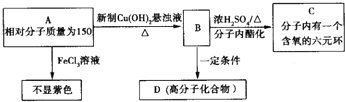
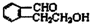 ;
;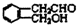 .
. ;此A对应的B生成C的反应:
;此A对应的B生成C的反应: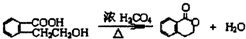 .
.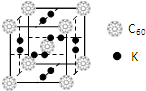 氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.
氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.