题目内容
回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;
⑦燃烧匙。常用于物质分离的是________________,其中根据物质沸点不同来分离物质的仪器是____________。(用序号填写)
(2)今欲用NaOH固体配制220mL 0.2mol/L的NaOH溶液。根据题意填空:
| A.配制该溶液应选用玻璃仪器_________mL容量瓶。 |
| B.用托盘天平称取 ________g NaOH固体。 |
| C.将称好的NaOH固体放至烧杯中,倒入约25mL蒸馏水,用__________搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。 |
| D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻摇动容量瓶,使溶液混和均匀。 |
F.配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。
(1)①③⑤ ③
(2)250 2.0 玻璃棒 胶头滴管 偏高 不能
解析试题分析:常用的物质分离的方法:过滤、萃取分液、蒸馏、分馏,各种方法所用的物质分离仪器有:漏斗、分液漏斗、蒸馏烧瓶,故选①③⑤。其中根据物质沸点不同来分离物质的仪器是蒸馏烧瓶。A.220mL 0.2mol/L的NaOH溶液,故需要250mL容量瓶;B.用托盘天平称量氢氧化钠,称取氢氧化钠的质量为0.25L×0.2mol?L-1×40g/mol=2.0g;C.溶解氢氧化钠固体,利用玻璃棒搅拌,加速溶解;故答案为:玻璃棒;E.加水定容时,直到液面离刻度线约2-3厘米时,改用胶头滴管滴加蒸馏水至液面与刻度线相切;故答案为:胶头滴管;如果溶液未冷却就进行定容,溶液会热胀,体积偏大,相当于水的量加少了,将使配得的溶液浓度偏高。F.过长时间存放可能会造成容量瓶的腐蚀,影响测定结果,短期内用容量瓶可以暂时储存,长期最好转移到试剂瓶内保存;
考点:本题考查了本题考查学生物质分离所需的仪器,要求学生熟悉常用的物质分离的方法,同时还考查一定物质的量浓度溶液的配制,比较基础,关键清楚溶液配制的原理,理解溶液配制,把握整个配制过程,注意氢氧化钠应放在烧杯内称量。

用Na2CO3固体配制1mol/L的Na2CO3溶液100mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③酒精灯;④100mL容量瓶;⑤250mL量筒;⑥天平;⑦50mL烧杯;应选用的仪器(填编号) 。
(2)应称取Na2CO3的质量为 g;若称量时砝码和物品放反了,则实际称量的Na2CO3的质量为 g 。
(3)下列操作,会引起所配溶液浓度偏高的是( )
| A.称取的Na2CO3固体中有杂质 |
| B.溶解Na2CO3固体时,因搅拌剧烈使烧杯中的溶液溅出少量 |
| C.没有洗涤烧杯及玻璃棒 |
| D.定容时发现液面高于刻度线,用胶头滴管吸出多余的溶剂 |
F、定容时俯视刻度线
G、定容摇匀后,发现液面低于刻度线,再加至刻度线
(4)取所配Na2CO3溶液20ml,向其中滴加足量的稀盐酸,可得到标况下的气体 L,将得到的气体全部通入足量的澄清石灰水,充分反应后,将沉淀过滤,洗涤,干燥,最后可得固体 g。
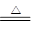 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算: