题目内容
实验室用Na2CO3·10H2O晶体配制0.02 mol/L的Na2CO3溶液480 mL。
(1)① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少 ;
② 实验中两次用到玻璃棒,其作用分别是 、 。
(2) 应用托盘天平称取Na2CO3·10H2O晶体的质量为: g。
(3)根据下列操作对所配溶液的浓度各有什么影响,将其序号填在下面空格:
①碳酸钠晶体失去了部分结晶水; ②用“左码右物”的称量方法称量晶体;
③碳酸钠晶体不纯,其中混有氯化钠; ④容量瓶中原有少量蒸馏水。
⑤定容时俯视液面;⑥摇匀后发现液面低于刻度线再加水。
其中引起所配溶液浓度:a.偏高的有 ;
b.偏低的有 ;
c.无影响的有 。
(1)①500 mL容量瓶(1分)、胶头滴管(1分) ② 搅拌,加快固体溶解(1分) 引流(1分)
(2)2.9 (2分) (3)a.①⑤ b.②③⑥ c. ④(每个序号1分)
解析试题分析:(1)根据操作步骤选取实验仪器;配制步骤有计算、称量、溶解、移液、洗涤、定容、摇匀等操作,固体药品一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,① 实验中用到的玻璃仪器有量筒、玻璃棒、烧杯,还缺少500 mL容量瓶、胶头滴管;② 实验中两次用到玻璃棒,其作用分别是搅拌,加快固体溶解、 引流。
(2)m=nM=CVM=0.02mol/L×0.5L×286g/mol=2.9g。
(3)①碳酸钠晶体失去了部分结晶水,导致称量溶质碳酸钠的质量增大,配制溶液的浓度偏高;②用“左码右物”的称量方法称量晶体导致称量溶质的质量增小,配制溶液的浓度偏低;③碳酸钠晶体不纯,其中混有氯化钠,导致碳酸钠的物质的量偏小,配制溶液的浓度偏低;④容量瓶未经干燥就使用不影响溶质的物质的量,也不影响溶液的体积,所以对配制的溶液浓度无影响;⑤定容时俯视液面,所配溶液的体积偏小,浓度偏高;⑥摇匀后发现液面低于刻度线再加水,所配溶液的体积偏大,浓度偏低;综上所述,偏高的为:①⑤,偏低的为:②③⑥,无影响的为:④。
考点:考查一定物质的量浓度溶液的配制。

铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )

(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下:
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
Ⅰ.实验室配制1mol/L Na2CO3溶液250ml。
(1)需要固体Na2CO3 g;(2)该溶液中的阳离子数目为 个;
(3)需要物质的量浓度为5mol/L 的Na2CO3溶液 ml;
(4)将该溶液与足量稀硫酸反应,产生的气体在标准状况下的体积为 L。
(5)配制该溶液的操作顺序是(用字母表示,不重复使用) 。
| A.称量 | B.洗涤 | C.定容 | D.溶解 E.摇匀 F.转移 |
回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;
⑦燃烧匙。常用于物质分离的是________________,其中根据物质沸点不同来分离物质的仪器是____________。(用序号填写)
(2)今欲用NaOH固体配制220mL 0.2mol/L的NaOH溶液。根据题意填空:
| A.配制该溶液应选用玻璃仪器_________mL容量瓶。 |
| B.用托盘天平称取 ________g NaOH固体。 |
| C.将称好的NaOH固体放至烧杯中,倒入约25mL蒸馏水,用__________搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。 |
| D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻摇动容量瓶,使溶液混和均匀。 |
F.配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。
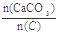 =2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同)
=2.2时,窑气中CO2的最大体积分数为多少?(设空气只含N2与O2,且体积比为4∶1,下同) 为何值?
为何值?