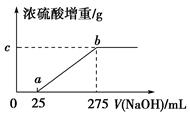
题目内容
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为 (填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为: ;该Na2CO3溶液的物质的量浓度为 ________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为 。
(1)4.2mol 0.2mol
(2)CD
(3)2NO2+Na2CO3=NaNO2+NaNO3+CO2
(4)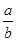 ≧
≧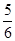
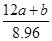
(5)1:5
解析试题分析:(1)2molNO反应,需要消耗2molNO2,生成了4mol NaNO2,还有0.4mol NO2和氢氧化钠反应,分别生成0.2mol NaNO2、0.2mol NaNO3,故生成了4.2mol NaNO2,0.2mol NaNO2。故答案是:n(NaNO2 )="4.2" mol n(NaNO3)="0.2" mol。
(2)由方程式可知,NO单独不能被吸收,NO和NO2混合气体被NaOH溶液被完全吸收,满足n(NO2):n(NO)≥1,当n(NO2):n(NO)=1时x值最小,x最小值为=1.5,因为混有NO,所以x最大值<2,故x的取值范围为1.5≤x<2,故选:CD
(3)二氧化氮与碳酸钠反应生成NaNO2、NaNO3、CO2,反应方程式2NO2+Na2CO3=NaNO2+NaNO3+CO2
(4)发生反应为:2NO2+Na2CO3=NaNO2+NaNO3+CO2,NO2+NO+Na2CO3=2NaNO2+CO2,从反应式就可以看出当n(NO2)/n(NO)≥1,气体就全部反应了,aLNO2,其中N2O4的体积分数是20%,把N2O4折换成NO2,NO2的体积总共为aL×(1-20%)+aL×20%×2=1.2aL,所以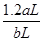 ≧1即
≧1即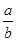 ≧
≧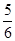 。 由Na元素可知:2n(Na2CO3)=n(NaNO2)+n(NaNO3),由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO)=
。 由Na元素可知:2n(Na2CO3)=n(NaNO2)+n(NaNO3),由N元素守恒可知n(NaNO2)+n(NaNO3)=n(NO2)+2n(N2O4)+n(NO)= 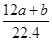 mol,所以n(Na2CO3)=
mol,所以n(Na2CO3)=  mol,该Na2CO3溶液的物质的量浓度为
mol,该Na2CO3溶液的物质的量浓度为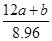 mol/L。
mol/L。
(5)设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol,x+y+z=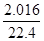 =0.09mol。根据得失电子守恒可得: 2x+y+3z=
=0.09mol。根据得失电子守恒可得: 2x+y+3z=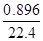 ×4,2x+y+z="0.05×2" (氮原子子守恒、钠离子守恒)。解得:x=0.01(mol),y=0.05(mol),z=0.03(mol) 所以V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5。
×4,2x+y+z="0.05×2" (氮原子子守恒、钠离子守恒)。解得:x=0.01(mol),y=0.05(mol),z=0.03(mol) 所以V(N2O4):V(NO2)=n(N2O4):n(NO2)=0.01:0.05=1:5。
考点:化学反应计算、守恒法。

回答下列问题(填序号):
(1)下列仪器中:①漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥量筒;
⑦燃烧匙。常用于物质分离的是________________,其中根据物质沸点不同来分离物质的仪器是____________。(用序号填写)
(2)今欲用NaOH固体配制220mL 0.2mol/L的NaOH溶液。根据题意填空:
| A.配制该溶液应选用玻璃仪器_________mL容量瓶。 |
| B.用托盘天平称取 ________g NaOH固体。 |
| C.将称好的NaOH固体放至烧杯中,倒入约25mL蒸馏水,用__________搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。 |
| D.用少量蒸馏水洗涤烧杯内壁和玻璃棒2-3次,并将每次洗涤的溶液都注入容量瓶, 轻轻摇动容量瓶,使溶液混和均匀。 |
F.配制好的溶液__________(填“能”或“不能”)长期存放在容量瓶中。
(1)下列物质中,物质的量最大的是________,含原子个数最多的是________,质量最大的是________。
| A.3gH2; | B.标况下33.6LCO2; | C.1.204×1024个HCl分子; | D.49gH2SO4;E.46g乙醇(C2H5OH);F.4℃时10mL水 |