题目内容
【题目】如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极![]() 接通电源,经过一段时间后,乙中c电极质量增加
接通电源,经过一段时间后,乙中c电极质量增加![]() 据此回答问题:
据此回答问题:
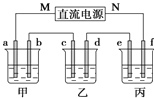
(1)电源的M端为_____________极;
(2)电极d上发生的电极反应式为__________; 乙池溶液PH__________填(“增大”、“减小”或“不变”)
(3)甲池中的总反应式为___________________________________;
(4)当电路中有0.04mol电子通过时,a、b、c、d电极上产生的气体或固体的物质的量之比是____________;
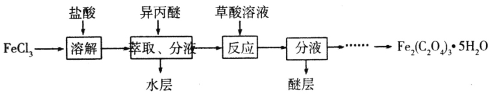
(5)若利用丙池实现铁上镀铜,则“e-f-x”![]() 溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
溶液是__________________________;(要求e、f、x用具体物质回答,下同),若利用丙池实现电解精炼铜,则f电极材料是_______________________
(6) 实验测得, 1g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出22.68kJ的热量,则表示甲醇燃烧热的热化学方程式为:_____________________________________________________
(7)亚硝酸氯![]() 结构式为
结构式为![]() 是有机合成中的重要试剂,可由
是有机合成中的重要试剂,可由![]() 和
和![]() 在通常反应条件下制得,反应方程式为
在通常反应条件下制得,反应方程式为![]() 。已知几种化学键的键能数据如下表所示:
。已知几种化学键的键能数据如下表所示:
化学键 |
|
|
|
|
键能 | 243 | a | 607 | 630 |
当![]() 与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为______kJ。(用数字和字母表示)
【答案】负 4OH--4e-=2H2O+O2↑ 减小 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑ ![]() :2:4:1 Fe-Cu-CuSO4 粗铜 CH3OH(l)+
:2:4:1 Fe-Cu-CuSO4 粗铜 CH3OH(l)+![]() O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1
O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1 ![]()
【解析】
由题意可知①乙中C电极质量增加,则c处发生的反应为:Ag++e-=Ag,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极,f为阳极,e为阴极,d为阳极,甲池是电解饱和氯化钠溶液;②依据电极反应电子守恒计算,乙中为AgNO3溶液,c为阴极电极反应Ag++e-=Ag,d电极为阳极,氢氧根离子失电子发生氧化反应。③若利用丙池实现铁上镀铜,所以e阴极是铁,f阳极是铜,电解质溶液是硫酸铜,若利用丙池实现电解精炼铜,e阴极是纯铜,f阳极是粗铜,电解质溶液是硫酸铜,根据此分析进行解答。
(1)接通电源,经过一段时间后,乙中c电极质量增加,说明c是银离子放电生成单质银,所以c是阴极,则M是负极,则N是正极。
故答案为: 负;
(2)电极d是阳极,氢氧根离子失电子发生氧化反应,电极上发生的电极反应式为4OH--4e-═2H2O+O2↑,
故答案为 4OH--4e-═2H2O+O2↑;
(3)甲池是电解饱和氯化钠溶液,总反应式为2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(4)当电路中有0.04mol电子通过时,a是氢离子放电,生成氢气,b是氯离子放电生成氯气、c极是银离子放电生成单质银、d电极是氢氧根离子放电生成氧气,所以有0.04mol电子通过时产生的气体或固体的物质的量分别是0.02mol、0.02mol、0.04mol、0.01mol,所以a、b、c、d电极上产生的气体或固体的物质的量之比是2:2:4:1。
故答案为 2:2:4:1
(5)若利用丙池实现铁上镀铜,所以e阴极是铁,f阳极是铜,电解质溶液是硫酸铜溶液。若利用丙池实现电解精炼铜,e阴极是纯铜,f阳极是粗铜,电解质溶液是硫酸铜溶液;
故答案为:Fe-Cu-CuSO4 ;粗铜;
(6)燃烧热指的是1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则32g甲醇即1mol甲醇燃烧放的热量为725.8kJ,其燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1;
O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1;
故答案为 CH3OH(l)+![]() O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1
O2(g)═CO2(g)+2H2O(l)△H=-725.76kJmol-1
(7)在化学反应过程中,反应物断键会吸收能量,生成物成键会释放能量。反应![]() 中,每反应2molNO,转移2mol电子,吸收的能量=2×
中,每反应2molNO,转移2mol电子,吸收的能量=2×![]() +
+![]() =1503 kJmol-1,释放的能量=2×
=1503 kJmol-1,释放的能量=2×![]() +2×
+2×![]() =2a+1214 kJmol-1,故放出的能量为2a-289 kJmol-1。若转移4mol电子,理论上放出的热量为2×(2a-289)=
=2a+1214 kJmol-1,故放出的能量为2a-289 kJmol-1。若转移4mol电子,理论上放出的热量为2×(2a-289)=![]() kJmol-1;
kJmol-1;
故答案为![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
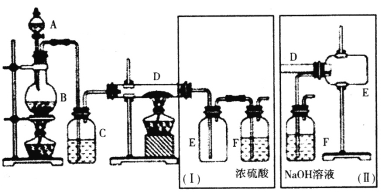
小学生10分钟应用题系列答案【题目】三氯化磷(PCl3)是一种基础化工原料使用广泛需求量大。实验室可用白磷与氯气反应制备三氯化磷,实验装置如图所示(夹持装置未画出)。
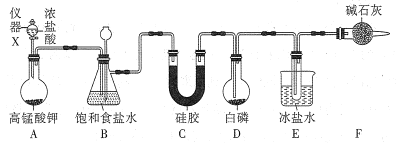
已知:①氯气与白磷反应放出热量(温度高于75℃)。
②PCl3和PCl5遇水强烈反应并产生大量的白雾。
③PCl3和PCl5的物理常数如下:
熔点 | 沸点 | |
PCl3 | -112℃ | 76℃ |
PCl5 | 146℃ | 200℃分解 |
回答下列问题:
(1)仪器X的名称是___;装置A中发生反应的离子方程式为___。
(2)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C或D中是否发生堵塞,若装置C或D中发生堵塞时B中的现象是__。
(3)为防止装置D因局部过热而炸裂,实验开始前应在圆底烧瓶的底部放少量__(填“干沙”或“水”)。
(4)装置E的烧杯中冰盐水的作用是___。
(5)装置F的作用:一是防止空气中水蒸气的进入;二是___。
(6)前期白磷过量生成PCl3,后期氯气过量生成PCl5,从PC13和PCl5的混合物中分离出PCl3的最佳方法是___。
【题目】下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为____________
(2)⑦的黄绿色单质的化学式为____________⑩的单质在常温下的存在状态为____________
(3)①的气态氢化物的水溶液显_______
(4)用电子式表示②与④形成化合物的过程______
(5)这些元素中的最高价氧化物对应的水化物中,碱性最强的是__呈两性的是__
(6)写出⑤与盐酸反应的化学方程式:__________________________写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:______